Publikationen im Fokus
Neuartiges Protokoll verbessert die 3D-Elektronenmikroskopie-Analyse
Modular segmentation, spatial analysis and visualization of volume electron microscopy datasets.
Nat Protoc. 2024
Die Volumenelektronenmikroskopie revolutioniert derzeit unser Wissen über Zellen und Gewebe, indem sie deren Struktur in drei Dimensionen abbildet. Jetzt haben Forscher des Paul-Langerhans-Instituts Dresden (PLID) des Deutschen Zentrums für Diabetesforschung ein neuartiges Protokoll vorgestellt, das die Analyse von dreidimensionalen elektronenmikroskopischen (3D-EM) Datensätzen verändern dürfte. In Zusammenarbeit mit Kollegen des Max-Delbrück-Centrums für Molekulare Medizin (MDC), der Humboldt-Universität zu Berlin, Helmholtz Imaging und der École Polytechnique Fédérale de Lausanne (EFPL) entwickelten die Wissenschaftler einen detaillierten Leitfaden, der sich an Forscherinnen und Forscher in Biologie und Medizin richtet und einen modularen und benutzerfreundlichen Workflow bietet, um die komplizierten Details der zellulären Ultrastruktur zu entschlüsseln. Dieses neuartige Protokoll wurde nun in der renommierten Fachzeitschrift "Nature Protocols" veröffentlicht.
Seit Jahrzehnten ist die zweidimensionale Elektronenmikroskopie der Eckpfeiler der zellbiologischen und medizinischen Forschung und ermöglicht detaillierte Einblicke in subzelluläre Strukturen. In den letzten Jahren hat der Aufschwung der dreidimensionalen Volumenelektronenmikroskopie (vEM) zu einer Fülle großer Rohbilddatensätze geführt, die fortschrittliche Analyseverfahren erfordern. Das neu entwickelte Protokoll trägt diesem Bedarf Rechnung, indem es umfassende Verfahren für die Vorbereitung der Rohdaten, die organellenspezifische Segmentierung, die räumliche Analyse der Segmentierungskarten und die 3D-Visualisierung bereitstellt.
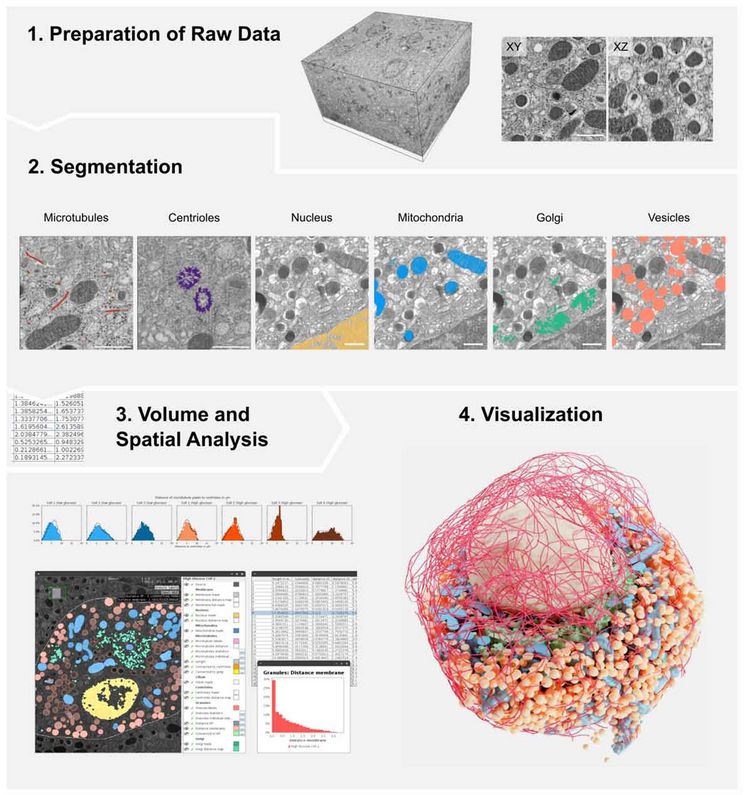
© PLID
Andreas Müller, leitender Wissenschaftler am PLID und Erstautor des Artikels, erläutert die Motivation hinter dem Protokoll: "Unser Ziel war es, die Herausforderungen zu vereinfachen, denen Forscher bei der Analyse kompletter Zellen in vEM-Datensätzen gegenüberstehen. Diese Datensätze sind riesig und die Segmentierung der zellulären Merkmale ist sehr zeitaufwändig. Hinzu kommt, dass es zwar viele verschiedene Software-Tools gibt, die bei dieser Aufgabe helfen, aber nicht alle sind benutzerfreundlich und einfach anzuwenden."
Die modulare Herangehensweise des Protokolls zeichnet sich als ein Schlüsselfeature aus und bietet einen vielseitigen Rahmen für die Analyse von virtueller Elektronenmikroskopie (vEM). Forscherinnen und Forscher können aus einer Vielzahl von Segmentierungsmethoden wählen, die auf spezifische Organellen zugeschnitten sind, wodurch unnötiger Annotationsaufwand reduziert und die zeitnahe Gewinnung von Projektergebnissen beschleunigt wird. Müller betont die Anpassungsfähigkeit des Workflows und merkt an: "Während das ursprüngliche Projekt, für das wir den Workflow entworfen haben, sich auf insulinproduzierende Betazellen der Bauchspeicheldrüse bezog, sind die Segmentierungs-, Analyse- und Rendering-Workflows darauf ausgelegt, sich problemlos an andere Zelltypen und vEM-Modalitäten anzupassen."
Der Vorteil des neuen Protokolls liegt in seiner einfachen Zugänglichkeit insbesondere für Wissenschaftler:innen mit moderaten Kenntnissen im Bereich der Datenverarbeitung. Das Protokoll ermutigt Benutzer:innen dazu, ihre bevorzugten Segmentierungswerkzeuge zu integrieren und bietet einen effizienten Prozess durch "Album"-Lösungen. "Album“ ist eine Plattform, die entwickelt wurde, um komplexe Analyse-Pipelines leichter verteilbar und reproduzierbar zu machen“, erklärt Deborah Schmidt, Leiterin des Helmholtz Imaging Solutions Teams am MDC und Mitautorin des Artikels. Diese innovative Methodik steht kurz davor, die Fortschritte in der Zellbiologie zu beschleunigen und ein klareres Verständnis der ultrastrukturellen Aspekte von Zellen zu ermöglichen. Martin Weigert, Forschungsgruppenleiter an der EFPL und Senior-Autor des Protokolls, fasst die Bedeutung zusammen und erklärt: "Unser Protokoll bietet einen umfassenden Überblick über zeitsparende und arbeitseffiziente Lösungen für die vEM-Analyse und sollte als nützliche Referenz für die breitere vEM-Forschungsgemeinschaft dienen."
Zusammenfassend stellt dieses wegweisende Protokoll von Andreas Müller und seinen Mitarbeitern einen bedeutenden Schritt zur Demokratisierung des Zugangs zu 3D-EM-Methoden dar, fördert die Zusammenarbeit und treibt die Grenzen der Zellforschung voran.
Original-Publikation:
Müller A, Schmidt D, Albrecht JP, Rieckert L, Otto M, Galicia Garcia LE, Fabig G, Solimena M, Weigert M. Modular segmentation, spatial analysis and visualization of volume electron microscopy datasets.Nat Protoc. 2024 Feb 29. doi: 10.1038/s41596-024-00957-5.
Neue mögliche Biomarker für Erkrankungen der Herzkranzgefäße entdeckt
Association of plasma proteomics with incident coronary heart disease in individuals with and without type 2 diabetes: results from the population-based KORA study.
Cardiovasc Diabetol 2024
Die Koronare Herzkrankheit ist ein großes globales Gesundheitsproblem, insbesondere bei Menschen mit Typ-2-Diabetes. Forschende des Deutschen Zentrums für Diabetesforschung (DZD), des Helmholtz Munich und der LMU konnten neue Protein-Biomarker identifizieren, die an der Entstehung von KHK bei Menschen mit bzw. ohne Diabetes beteiligt sind. Die Ergebnisse sind in ‚Cardiovascular Diabetology‘ erschienen.
Weltweit ist die koronare Herzkrankheit (KHK) eine der häufigsten Todesursachen - insbesondere in Europa: Hier ist sie für fast die Hälfte aller Todesfälle verantwortlich. Bei Erwachsenen mittleren Alters haben Menschen mit Typ-2-Diabetes (T2D) ein zwei- bis viermal höheres Risiko, an KHK zu erkranken als Personen ohne T2D. Das Forschungsteam untersuchte, wie gut Protein-Biomarker das Auftreten von KHK bei Personen mit und ohne T2D vorhersagen können.
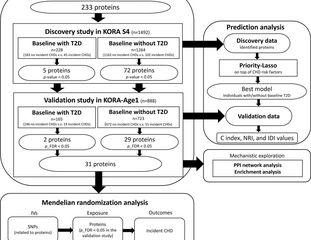
Die Forschenden nutzten für ihre Studie Daten aus der Kooperativen Gesundheitsforschung in der Region Augsburg (KORA). Die Validierungskohorte umfasste 888 Teilnehmende der KORA-Age1-Studie mit 70 erstmaligen Fällen von KHK (19 vs. 51 Fälle in der Gruppe mit T2D und ohne T2D) während einer Nachbeobachtungszeit von 6,9 Jahren. Sie überprüften Blutproben der Probanden auf 233 Plasmaproteine, die mit kardiovaskulären Erkrankungen und Entzündungen zusammenhängen.
So konnten die Forschenden zwei Proteine identifizieren, die mit dem erstmaligen Auftreten von KHK bei Personen mit Diabetes und 29 Proteine bei Personen ohne T2D zum Zeitpunkt der Baseline verbunden waren. Sechs dieser Proteine sind neue Kandidaten für das erstmalige Auftreten von KHK.
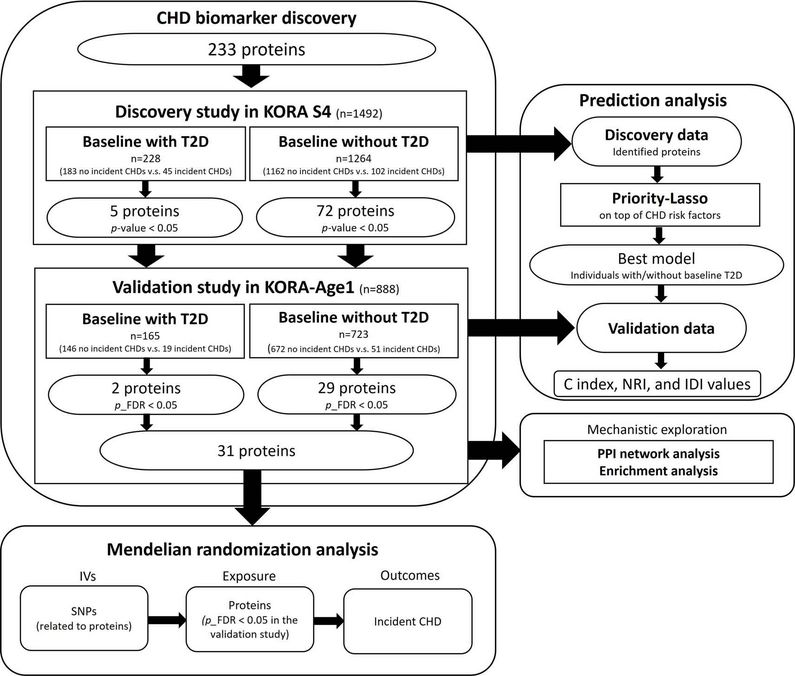
© Helmholtz Munich
Die Ergebnisse dieser Studie tragen wesentlich zum Verständnis der Pathophysiologie von KHK bei T2D-Patient:innen bei und bieten potenzielle neue Ansätze für die Prävention und Behandlung dieser schwerwiegenden Komplikation. Sie unterstreichen die Bedeutung weiterer Forschung auf diesem Gebiet und die Rolle des Deutschen Zentrums für Diabetesforschung bei der Lösung drängender Fragen im Zusammenhang mit Diabetes und seinen Folgeerkrankungen.
Original-Publikation:
Luo, H., Huemer, MT., Petrera, A. et al. Association of plasma proteomics with incident coronary heart disease in individuals with and without type 2 diabetes: results from the population-based KORA study. Cardiovasc Diabetol 23, 53 (2024). https://doi.org/10.1186/s12933-024-02143-z
Regenerative Medizin: Bessere Verfügbarkeit von Bauchspeicheldrüsen-Vorläuferzellen
Regulation of multiple signaling pathways promotes the consistent expansion of human pancreatic progenitors in defined conditions.
Elife 2024
Forschende des DZD-Partners Paul-Langerhans-Institut Dresden haben Mechanismen zur Vermehrung (Expansion) und Differenzierung von Vorläuferzellen der Bauchspeicheldrüse (Pankreasprogenitorzellen, PP) identifiziert. Diese könnten künftig helfen, PP-Zellen, die aus humanen pluripotenten Stammzellen (hPS-Zellen) stammen, unbegrenzt zu vermehren. Die Ergebnisse, veröffentlicht in "Elife", versprechen neue Wege zur Behandlung von Diabetes.
Fast zehn Prozent der Weltbevölkerung ist an Diabetes erkrankt und in schweren Fällen ist zur Behandlung eine Transplantation der gesamten Bauchspeicheldrüse oder der insulinproduzierenden Inselzellen erforderlich. Allerdings begrenzt derzeit die geringe Spendenbereitschaft für Organe die breite Anwendung dieser Diabetes-Behandlung. Darüber hinaus sind Betroffene lebenslang auf Medikamente angewiesen, die das Immunsystem unterdrücken, damit die transplantierten Organe nicht vom Körper abgestoßen werden. Daher arbeiten Wissenschaftler:innen des DZD daran, humane pluripotente Stammzellen (hPS-Zellen) für die Gewinnung von insulinproduzierenden Zellen nutzbar zu machen.
Chemisch optimiertes Expansionsmedium entkoppelt die PP-Proliferation von der Differenzierung
Dem Team um Prof. Anthony Gavalas am Paul-Langerhans-Institut Dresden sind bereits wichtige Fortschritte bei der Expansion von Vorläuferzellen gelungen, die aus hPS-Zellen abgeleitetet wurden. Nach ihren kürzlich veröffentlichten Ergebnissen bestand die größte Herausforderung darin, die Selbsterneuerung von PP-Zellen aufrechtzuerhalten und gleichzeitig ihre Differenzierung zu hemmen. Ihr chemisch optimiertes Zellkulturmedium entkoppelt die Proliferation der PP-Zellen von deren Differenzierung und erlaubt eine bis zu 2000-fache Expansion über 10 Passagen und 40-45 Tage, ohne dabei die Differenzierung zu beeinträchtigen.
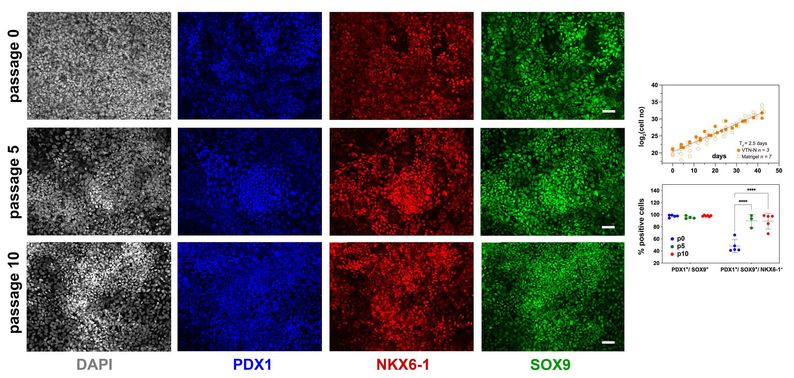
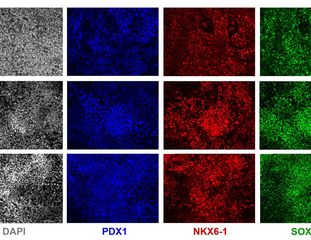
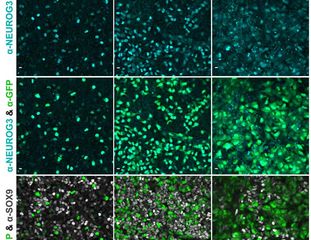
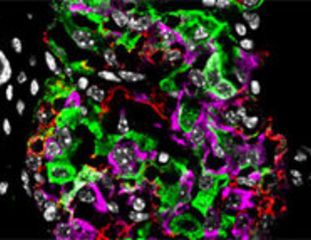
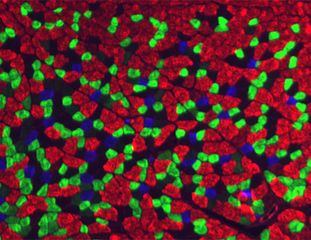
Repräsentative Bilder der Immunfluoreszenzfärbung für die PP-Transkriptionsfaktoren PDX1, NKX6.1 und SOX9 nach O, 5 und 10 Passagen. © PLID
Vielversprechende Aussicht: Die Methode ist skalierbar
Die Methode ist vielseitig und skalierbar. Die Forschenden haben das Verfahren patentiert und eine Vereinbarung zur kommerziellen Entwicklung getroffen.
Diese zukunftsweisende Arbeit markiert einen wichtigen Meilenstein auf dem Weg zu wirksameren Diabetesbehandlungen und zeigt das Potenzial der regenerativen Medizin.
Original-Publikation:
Jarc L, Bandral M, Zanfrini E, Lesche M, Kufrin V, Sendra R, Pezzolla D, Giannios I, Khattak S, Neumann K, Ludwig B, Gavalas A. Regulation of multiple signaling pathways promotes the consistent expansion of human pancreatic progenitors in defined conditions. Elife. 2024 Jan 5;12:RP89962. doi: 10.7554/eLife.89962.
Beeinflusst Metformin die Gehirnentwicklung? Forschungsdaten aus einer Studie mit Mäusen
Developmental metformin exposure does not rescue physiological impairments derived from early exposure to altered maternal metabolic state in offspring mice.
Molecular Metabolism 2023
Die Zahl der Frauen, die in der Schwangerschaft einen Gestationsdiabetes entwickeln, steigt seit Jahren an. Zur Behandlung eingesetzte Diabetesmedikamente wie Metformin passieren die Plazentaschranke. Im Fachblatt Molecular Metabolism berichten Forschende von einer Studie mit Mäusen, in der Metformin die Gehirnentwicklung des Nachwuchses beeinflusste – wie genau, war vom Stoffwechselstatus der Muttertiere abhängig.
Die Hirnregion des Hypothalamus spielt eine zentrale Rolle bei der Regulierung des Energiehaushalts. Bei Mäusen wird die neuronale Konnektivität im Hypothalamus in den ersten Wochen nach der Geburt etabliert. Ein kritisches Zeitfenster, in dem eine antidiabetische Therapie zu Veränderungen führen könnte. Das Diabetesmedikament Metformin wirkt zum Beispiel auf das Enzym AMPK, welches während der Gehirnentwicklung das Wachstum der Axone steuert.
Fettreiche oder normale Kost
Forschende des Deutschen Instituts für Ernährungsforschung Potsdam-Rehbrücke, Nuthetal, des Deutschen Zentrums für Diabetesforschung (DZD), München-Neuherberg, und der Charité- Universitätsmedizin Berlin haben untersucht, wie sich eine Behandlung mit Metformin und der Stoffwechselzustand der Mutter auf Physiologie und Gehirnentwicklung der Jungtiere auswirken.
Für die Studie erhielten Mäuseweibchen vor der Verpaarung und während der Trächtigkeit und Laktation entweder eine normale oder eine fettreiche Kost. Adipositas und eine übermäßige Gewichtszunahme in der Schwangerschaft sind die Hauptrisikofaktoren für einen Gestationsdiabetes. Die fettreich gefütterten Mäuse entwickelten Anzeichen für eine Stoffwechselstörung und waren am Ende der Laktationsphase hyperglykämisch.
Metformin in der Phase der Gehirnentwicklung
In den ersten drei Wochen nach der Geburt erhielten sowohl die Muttertiere als auch die Jungen Metformin. Ein Gestationsdiabetes wird üblicherweise zwischen Schwangerschaftswoche 24 und 28 diagnostiziert und eine medikamentöse Behandlung erfolgt im dritten Trimester. Hinsichtlich der Gehirnentwicklung entspricht die Laktationsphase bei Nagern dem dritten Trimester einer menschlichen Schwangerschaft.
Die Behandlung mit Metformin hatte messbare, aber uneinheitliche Auswirkungen auf das Gewicht und die Hormone des Nachwuchses. Außerdem beobachteten die Forschenden Effekte auf verschiedene Komponenten der AMPK-Signalkaskade im sich entwickelnden Hypothalamus der jungen Mäuse. Diese wurden von der Metformintherapie, aber auch der Ernährung des Muttertieres und dem Geschlecht der Nachkommen bestimmt.
Die Wissenschaftlerinnen und Wissenschaftler erklären, dass frühe Veränderungen im Hypothalamus die Nachkommen im späteren Leben für Stoffwechselerkrankungen prädisponieren könnten. In künftigen Studien könnten die Jungtiere bis ins Erwachsenenalter beobachtet werden, um die langfristigen Effekte der Metformintherapie besser zu verstehen.
Original-Publikation:
Lídia Cantacorps, Jiajie Zhu, Selma Yagoub, Bethany M. Coull, Joanne Falck, Robert A. Chesters, Katrin Ritter, Miguel Serrano-Lope, Katharina Tscherepentschuk, Lea-Sophie Kasch, Maya Paterson, Paula Täger, David Baidoe-Ansah, Shuchita Pandey, Carla Igual-Gil, Annett Braune, Rachel N. Lippert. Developmental metformin exposure does not rescue physiological impairments derived from early exposure to altered maternal metabolic state in offspring mice. Molecular Metabolism 2023 Dec 23; doi: 10.1016/j.molmet.2023.101860.
Neurogenin-3 in Pankreaszellen: Schon niedrige Expression könnte Diabetes verhindern
Integrating single-cell imaging and RNA sequencing datasets links differentiation and morphogenetic dynamics of human pancreatic endocrine progenitors.
Developmental Cell 2023
Im menschlichen Embryo entwickeln sich die endokrinen Zellen der Langerhans-Inseln aus den epithelialen Pankreas-Vorläuferzellen. Der Transkriptionsfaktor Neurogenin3 ist für die Differenzierung wichtig. Nur mit seiner Hilfe können sich etwa die insulinproduzierenden Betazellen bilden. Mutationen im Neurogenin-3-Gen führen zu Diabetes. Forschende haben eine Methode entwickelt, mit der sie die Expression des Neurogenin-3-Gens in menschlichen Pankreaszellen beobachten können. So entdeckten sie, dass schon eine schwache Expression die Bildung von Betazellen ermöglicht, um Diabetes vorbeugen zu können.
Die Langerhans-Inseln der Bauchspeicheldrüse enthalten verschiedene endokrine Zellen, die für die Regulation des Kohlenhydratstoffwechsels wichtige Hormone produzieren. Während die Betazellen das blutzuckersenkende Hormon Insulin bilden, produzieren die Alphazellen zum Beispiel seinen Gegenspieler Glukagon.
Neurogenin-3 entscheidend für Differenzierung
Der Transkriptionsfaktor Neurogenin-3 sorgt in der Entwicklung der Bauchspeicheldrüse für die Differenzierung dieser endokrinen Zelltypen aus den epithelialen Vorläuferzellen des Pankreas. Die höchste Konzentration von Neurogenin3 findet sich deshalb in der Phase der frühen Organogenese, zur Geburt hin nimmt sie deutlich ab. In Bauchspeicheldrüsen von Erwachsenen findet sich praktisch kein Neurogenin-3 mehr.
Forschende des Max-Planck-Instituts für molekulare Zellbiologie und Genetik in Dresden und des DZD-Partners Paul-Langerhans-Institut Dresden von Helmholtz Munich am Universitätsklinikum Carl Gustav Carus der TU Dresden sowie der Novo Nordisk Foundation an der Universität Kopenhagen haben untersucht, wie sich Neurogenin-3 in einzelnen Zellen verhält.
Schwache Expression reicht aus
Sie entwickelten 2- und 3-dimensionale Modelle aus jungen menschlichen Pankreaszellen, in denen sie Neurogenin3 mittels spezieller Marker lokalisieren können. So entdeckten sie, dass das Neurogenin-3-Gen in verschiedenen Pankreaszellen unterschiedlich exprimiert wird. Einige Zellen exprimieren das Gen stark, andere nur schwach. Überraschend für die Forschenden: Trotz der unterschiedlich starken Expression waren alle Pankreaszellen endokrin aktiv und bildeten Hormone.
Offenbar sind selbst kleine Mengen Neurogenin-3 ausreichend, um die Differenzierung in endokrine Zellen anzustoßen und zum Beispiel Betazellen zu bilden. Das ist den Forschenden zufolge wichtig, denn es erklärt, weshalb Mutationen mit geringerer Wirkung im Neurogenin-3-Gen bei Menschen noch keinen Diabetes auslösen. Nur Mutationen, die die Funktion des Gens stark beeinträchtigen, führen zu Diabetes.
Betazellentstehung braucht Zeit
Und eine weitere Erkenntnis: Neurogenin3 arbeitet bei Menschen langsamer als bei Mäusen. Für die Forschenden ist dies ein Hinweis darauf, dass dieses Gen bei Menschen mehr Zeit braucht, um seine Aufgabe zu erfüllen. Die Differenzierung epithelialer Vorläuferzellen in Beta- oder Alphazellen erfordert bei Menschen doppelt so viel Zeit wie bei den Nagern.
Die von den Forschenden entwickelten Zellkultursysteme helfen dabei, besser zu verstehen, wie Zellen in menschlichen Embryonen Organe bilden. Die Beobachtung von Neurogenin-3 in einzelnen Zellen zeigt, wie die Aktivität bestimmter Gene während der embryonalen Entwicklung zu Diabetes im späteren Leben führen kann.
Original-Publikation:
Belin Selcen Beydag-Tasöz, Joyson Verner D’Costa, Lena Hersemann, Byung Ho Lee, Federica Luppino, Yung Hae Kim, Christoph Zechner, Anne Grapin-Botton. Integrating single-cell imaging and RNA sequencing datasets links differentiation and morphogenetic dynamics of human pancreatic endocrine progenitors. Developmental Cell 2023 Aug 16; doi: 10.1016/j.devcel.2023.07.019
Insulinsensitivität des Gehirns verändert sich im Verlauf des Menstruationszyklus
Brain insulin action on peripheral insulin sensitivity in women depends on menstrual cycle phase.
Nature Metabolism 2023
Die Insulinaktivität im Gehirn beeinflusst das Essverhalten, den Stoffwechsel sowie die Fettverteilung im Körper – und verstärkt insbesondere die Insulinsensitivität im Rest des Körpers. Doch all diese Erkenntnisse wurden vorwiegend bei Männern gewonnen. Im Fachblatt Nature Metabolism berichten Forschende, dass die Insulinaktivität im Gehirn zwar auch bei Frauen die Insulinsensitivität im Rest des Körpers verbessert, aber nur in der Follikelphase des Zyklus.
Über die letzten 10 Jahre wurde gezeigt, dass das Gehirn ein insulinsensitives Organ ist, aber auch, dass eine ganze Reihe von Menschen nicht auf Insulin im Gehirn ansprechen. Man spricht bei ihnen von einer Insulinresistenz des Gehirns. Sie findet sich besonders häufig bei Personen mit Adipositas, aber auch genetische Faktoren, erhöhte Blutfette und eine Beeinträchtigung des Insulintransports über die Blut-Hirn-Schranke spielen eine Rolle. Präklinische Studien deuten zudem auf Unterschiede zwischen Männern und Frauen hin.
Forschende der Universität Ulm sowie der DZD-Partner am Institut für Diabetesforschung und Metabolische Erkrankungen von Helmholtz München an der Universität Tübingen und Deutsches Diabetes-Zentrum in Düsseldorf untersuchten die Aktivität von Insulin im Gehirn bei 11 Frauen zu verschiedenen Zeitpunkten im Menstruationszyklus. Die Probandinnen waren schlanke, gesunde Frauen, die einen regelmäßigen, natürlichen Zyklus hatten.
Per Nasenspray gelangt Insulin vorwiegend ins Gehirn
Die Insulinaktivität im Gehirn wurde mittels hyperinsulinämisch-euglykämischer Clampuntersuchung gemessen, nachdem die Frauen ein Nasenspray mit Insulin oder einem Placebo erhalten hatten. Über die Nase verabreicht, erreicht ein wesentlicher Teil des Insulins das Gehirn, während nur ein winziger Teil in die Blutbahn gelangt. Deshalb erlaubt es die nasale Applikation, die Insulinaktivität im Gehirn zu stimulieren, ohne dass es zu Nebenwirkungen im Rest des Körpers kommt.
In der Follikelphase des Menstruationszyklus führte die Stimulation der Insulinwirkung im Gehirn zu einer Verbesserung der Ganzkörper-Insulinsensitivität. In der Lutealphase dagegen hatte das nasal applizierte Insulin bzw. die Insulinaktivität im Gehirn keinen solchen Effekt.
Insulinsensitivität in Follikel- und Lutealphase unterschiedlich
Auf diese Weise fanden die DZD-Forschenden heraus, dass während der Follikelphase des Menstruationszyklus im Gehirn eine erhöhte Insulinsensitivität besteht, die während der Lutealphase nicht zu beobachten ist.
In einer Untersuchung mit 15 weiteren Frauen, bei denen funktionelle MRT-Scans des Gehirns durchgeführt wurden, bestätigten sich diese Erkenntnisse. Mit einem funktionellen MRT lässt sich die Insulinsensitivität im Hypothalamus messen. Die Veränderung der Durchblutung in dieser Hirnregion wird als Maß der zentralen Insulinsensitivität nach der nasalen Verabreichung von Insulin verwendet. Die Responsivität des Hypothalamus wurde in der Follikelphase durch Insulin beeinflusst, in der Lutealphase aber nicht.
Die Forschenden schlussfolgern, dass die Insulinaktivität im Gehirn die periphere Insulinsensitivität auch bei Frauen verbessert, aber nur in der Follikelphase. Sie vermuten, dass die Insulinresistenz des Gehirns in der Lutealphase des Menstruationszyklus in dieser Zeit zu einer Insulinresistenz des gesamten Körpers beitragen könnte.
Original-Publikation:
Julia Hummel, Charlotte Benkendorff, Louise Fritsche, Katsiaryna Prystupa, Andreas Vosseler, Sofiya Gancheva, Sandra Trenkamp, Andreas L. Birkenfeld, Hubert Preissl, Michael Roden, Hans-Ulrich Häring, Andreas Fritsche, Andreas Peter, Robert Wagner, Stephanie Kullmann, Martin Heni. Brain insulin action on peripheral insulin sensitivity in women depends on menstrual cycle phase. Nat Metab 2023;5:1475–1482; doi:10.1038/s42255-023-00869-w
Molekulare Grundlage von Diabetes verstehen: Einzelzell-Atlas nutzt maschinelles Lernen
Delineating mouse β-cell identity during lifetime and in diabetes with a single cell atlas.
Nature Metabolism 2023
Informatiker:innen und Diabetesforscher:innen vomm DZD-Partner Helmholtz Munich haben gemeinsam neuartige Erkenntnisse über die grundlegenden Mechanismen von Typ-1- und Typ-2-Diabetes erlangt. Die Zusammenarbeit führte zur Erstellung des ersten Maus-Inselzell-Atlas (englisch: mouse islet atlas, MIA). Mit Hilfe von maschinellem Lernen wurden Einzelzell-Datensätze integriert, um die molekularen Veränderungen von Diabetes aufzudecken und die Unterschiede zwischen Typ-1- und Typ-2-Diabetes zu enthüllen. Die Ergebnisse wurden nun in dem Fachjournal 'Nature Metabolism' veröffentlicht.
Der Verlust oder eine Veränderung in der Funktion der insulinproduzierenden Zellen in der Bauchspeicheldrüse, den β-Zellen, mit einer fehlerhaften Regulation des Blutzuckers als Folge, verursacht Typ-1 (T1D) und Typ-2-Diabetes (T2D). Die β-Zellen und andere Zelltypen in den sogenannten Langerhans-Inseln der Bauchspeicheldrüse kommunizieren miteinander und regulieren gemeinsam durch die Ausschüttung von Hormonen den Blutzuckerspiegel. Die Messung des Insulinspiegels im Blut ist die am häufigsten angewendete Methode, um die Funktion der β-Zellen zu untersuchen. Allerdings reicht diese Methode nicht aus, um den präzisen Mechanismus aufzudecken, dem β-Zelltod während der Autoimmunreaktion bei T1D oder im Zusammenhang mit einer β-Zell-Insuffizienz nach erhöhten Blutzucker- und Lipidspiegeln bei T2D zugrunde liegt. Um den Mechanismus genauer zu verstehen, untersuchen Forschende weltweit die Genexpression der Bauchspeicheldrüsen durch die Analyse der RNA in einzelnen Zellen in Mausmodellen. Die daraus entstandenen Einzelzell-Genexpressions-Datensätze (scRNA-seq) enthalten hunderttausende von Zellen, wobei in jeder Zelle tausende von Genen gemessen werden. Bisher war es aufgrund der Vielzahl von Faktoren wie dem Krankheitsverlauf, den verschiedenen Arten von Inselzellen, den genetischen Unterschieden zwischen Mausstämmen und Diabetes-Modellen sowie den unterschiedlichen Labormethoden und der Datenverarbeitung schwierig, eine einheitliche molekulare Erklärung für die β-Zellinsuffizienz bei Diabetes zu ermitteln. Sodass es bisher die genauen Ursachen von T1D und T2D nicht vollständig verstanden werden konnten.
Ein Team aus der Forschungsgruppe von Prof. Fabian Theis zusammen mit einem Team um Prof. Heiko Lickert, beide von Helmholtz Munich, hat sich neueste Fortschritte im maschinellen Lernen, insbesondere im Bereich des Deep Representation Learning und der Datenintegration zu Nutzen gemacht, um den Maus-Inselzell-Atlas (MIA) zu entwickeln. Ein Atlas auf Ebene der Zellen ist eine umfassende Sammlung von Daten mit detaillierten Informationen über zelluläre Funktionen und wird von Forschenden als Ressource über Zellbiologie genutzt. Der MIA integriert neun scRNA-seq-Datensätze und über 300.000 Einzelzellen mit 1.000-8.000 Genen pro Zelle. MIA stellt die erste umfassende Zusammenstellung von Einzelzellendaten aus Mäusebauchspeicheldrüsen dar. Durch die Integration dieser Datensätze konnten die Wissenschaftler:innen bereits Veränderungen in der Genexpression von β-Zellen von einem gesunden zu einem erkrankten Zustand bei T1D und T2D oder während des Alterungsprozesses entschlüsseln. Dies ermöglicht schließlich die Identifizierung molekularer Zielstrukturen zur Prävention von β-Zellinsuffizienz. Zusätzlich trägt die Integration und der direkte Vergleich von Daten aus verschiedenen Datensätzen und Laboren dazu bei, in der Forschungsgemeinschaft einen Konsens zu schaffen.
Der Maus-Inselzell-Atlas zeigt Veränderungen in der β-Zellfunktion auf
Mit Hilfe des MIA konnten die Autor:innen die Unterschiede und Gemeinsamkeiten der molekularen Veränderungen bei T1D und T2D identifizieren. Es wurde gezeigt, dass β-Zellen bei gesunden Erwachsenen eine bemerkenswerte Vielfalt aufweisen. Diese Zellen zeigen variierte Ausprägungen von Zellstress, der durch die Insulinproduktion verursacht wird, sowie von Mustern, die mit dem Alterungsprozess zusammenhängen. Zudem trug MIA auch zur Klärung bei, welche Mausmodelle für die Erforschung von menschlichem T1D und T2D verwendet werden sollten. So werden experimentelle Studien in Zukunft leichter planbar sein. Das Streptozotocin-Modell, ein weit verbreitetes experimentelles Modell, bei dem die β-Zellen chemisch zerstört werden, wurde bisher sowohl für T1D als auch für T2D Forschung verwendet. Jedoch zeigen die neusten Erkenntnisse, dass das Modell eher T2D widerspiegelt. Des Weiteren wurde in allen Diabetesmodellen ein intermediärer Zustand der β-Zellen zwischen gesunden und diabetischen Mäusen beobachtet. Dieser Zustand sowie die molekularen Signalwege, die in diesen β-Zellen aktiv sind, könnten eine Rolle in der Entstehung oder Bekämpfung von Diabetes spielen und bieten potenzielle Zielmoleküle für zukünftige Behandlungsstrategien. Insgesamt ist die Studie ein herausragendes Beispiel, wie die Integration umfangreicher Datensätze und der resultierende Maus-Inselzell-Atlas (MIA) genutzt werden können, um eine Vielzahl von Einzelzell-Datensätzen aus Laboren auf der ganzen Welt zu bewerten. So entsteht nicht nur ein Konsens über die Entstehung von Diabetes, sondern es können auch neue Erkenntnisse gewonnen werden, die mit einzelnen Datensätzen allein nicht erreichbar wären.
Der Atlas ist eine wichtige Ressource für zukünftige Forschung
MIA stellt eine umfassende Ressource dar, die sowohl interaktive Exploration durch cellxgene und eine computergestützte Analyse ermöglicht. Zum Beispiel kann MIA verwendet werden, um herauszufinden, welche Zellen ein Gen von Interesse exprimieren und wie stark das Gen exprimiert wird. Neue Proben können auch im Hinblick auf die Bedingungen innerhalb von MIA interpretiert werden, indem sie auf den Atlas abgebildet werden. In Zukunft kann MIA weiter ausgebaut und aktualisiert werden, um kontinuierlich neu generierte Daten zu erfassen.
Original-Publikation:
Hrovatin, K. et al. (2023): Delineating mouse β-cell identity during lifetime and in diabetes with a single cell atlas. Nature Metabolism.
Möglicher Biomarker für Vorhersage von Typ-2-Diabetes entdeckt
Differences in DNA methylation of HAMP in blood cells predicts the development of type 2 diabetes.
Mol Metab 2023
Adipositas und eine nichtalkoholische Fettleber gehören zu den Hauptrisikofaktoren für Typ-2-Diabetes. Erkranken adipöse Menschen an Diabetes, muss dies rasch erkannt werden. Nur so ist eine frühzeitige Therapie möglich, die diabetischen Folgeerkrankungen vorbeugt. Im Fachblatt Molecular Metabolism berichten Forschende von einem epigenetischen Biomarker, der einen bevorstehenden Typ-2-Diabetes vorhersagen kann.
Epigenetische Veränderungen ermöglichen es der DNA, auf Umwelteinflüsse zu reagieren. Eine Methylgruppe, gebunden an eine bestimmte DNA-Sequenz, kann das Ablesen von Genen blockieren oder freigeben. Welche epigenetischen Veränderungen sich bei einem Menschen durchsetzen, bestimmen unter anderem die Essgewohnheiten und weitere Aspekte der Lebensführung. Auch bei der Entstehung von Adipositas und Diabetes spielen epigenetische Faktoren eine Rolle.
Um einen frühzeitig und leicht messbaren Biomarker für das Diabetesrisiko zu finden, untersuchten die Forschenden der DZD-Partner Deutsches Institut für Ernährungsforschung (DIfE) und Helmholtz Munich sowie des assoziierten Partners in Lübeck zunächst die DNA von adipösen Mäusen.
Vergleich von Mäusen mit unterschiedlichem Diabetesrisiko
Die untersuchten weiblichen Mäuse hatten trotz ihrer Fettleibigkeit aufgrund kleiner Variationen im Leberfettgehalt ein ganz unterschiedliches Diabetesrisiko: Während die eine Gruppe von ihnen diabetesresistent war, war die andere Gruppe besonders anfällig für Diabetes.
Eine Analyse der DNA-Expression und -Methylierung in den Lebern der Nager ergab, dass das Gen HAMP in den Lebern der diabetesanfälligen Mäuse um 52% weniger stark exprimiert wurde als bei diabetesresistenten Mäusen. Als Ursache für die verringerte Expression stellte sich eine verstärkte DNA-Methylierung an mehreren Stellen im Promotor des Gens heraus.
HAMP kodiert für das eisenregulierende Hormon Hepcidin, welches sich in den Lebern von diabetesanfälligen Mäusen in geringerer Konzentration fand.
Bestätigung bei menschlichen Probanden
Die Forschenden analysierten außerdem Gewebeproben aus den Lebern von adipösen, insulinresistenten Frauen. Sie stellten fest, dass auch bei ihnen die Expression des HAMP-Gens signifikant herunterreguliert war und der Promotor an der zum Tiermodell homologen Stelle methyliert war.
Ein leicht zu messender Biomarker sollte allerdings auch leicht zugänglich sein, etwa durch eine Blutabnahme. Deshalb analysierten die Forschenden auch noch die DNA-Methylierung des HAMP-Gens in Blutzellen, die etwa vier Jahre vor der Diabetesdiagnose von Teilnehmenden der prospektiven EPIC-Potsdam-Kohorte entnommen wurden. Es zeigte sich, dass auch hier eine robuste Assoziation zwischen der Methylierung an bestimmten CpG-Stellen Bereich des HAMP-Gens und dem Risiko für eine Diabetes-Neuerkrankung bestand.
Früher Marker für bevorstehende Diabeteserkrankung
Die Forschenden schlussfolgern, dass ihre Untersuchungen nicht nur neue Einsichten in die epigenetischen Veränderungen des HAMP-Gens vor der Entstehung eines Typ-2-Diabetes lieferten. Sie zeigten auch, dass HAMP beziehungsweise dessen epigenetische Veränderungen als früher Marker für einen bevorstehenden Typ-2-Diabetes dienen könnten.
Original-Publikation:
Meriem Ouni, Fabian Eichelmann, Markus Jähnert, Christin Krause, Sophie Saussenthaler, Christiane Ott, Pascal Gottmann, Thilo Speckmann, Peter Huypens, Stefan Wolter, Oliver Mann, Martin Hrabé De Angelis, Johannes Beckers, Henriette Kirchner, Matthias B. Schulze, Annette Schürmann. Differences in DNA methylation of HAMP in blood cells predicts the development of type 2 diabetes. Mol Metab 2023 Sep; doi: 10.1016/j.molmet.2023.101774.
Lernen der Insulinantwort
Glucose‑stimulated insulin secretion depends on FFA1 and Gq in neonatal mouse islets.
Diabetologia 2023
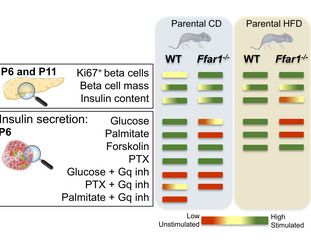
Die Fähigkeit der Betazellen des Pankreas, bei steigendem Glukosespiegel adäquat Insulin auszuschütten, muss sich bei neugeborenen Mäusen erst noch entwickeln. Forschende des DZD haben entdeckt, dass der Freie-Fettsäure-Rezeptor 1 (FFA1) entscheidend dafür ist, dass sich die Nachkommen an metabolische Herausforderungen anpassen können, etwa an eine fettreiche Ernährung der Mutter. Therapien, die an FFA1 angreifen, könnten es künftig ermöglichen, den Nachwuchs besser vor den Folgen mütterlicher Adipositas zu schützen.
Die Betazellen im Pankreas neugeborener Mäuse müssen eine Reihe von Reifungsprozessen durchlaufen, bevor sie in der Lage sind, bei der Zufuhr von Glukose Insulin auszuschütten. Diese funktionelle Reifung der Betazellen findet schrittweise in der frühen postnatalen Phase statt. Umweltfaktoren wie der Stoffwechsel der Mutter und die Fütterung mit Muttermilch spielen eine wichtige Rolle für die spätere Funktionsfähigkeit der Betazellen des Nachwuchses.
FFA1 ermöglicht Anpassung an metabolische Herausforderungen
Forschende des DZD-Partners Institut für Diabetes und Metabolismus Forschung (IDM) von Helmholtz Munich an der Universitätsklinik Tübingen untersuchten, welche Rolle der Freie-Fettsäure-Rezeptor 1 (FFA1) bei der Reifung der Betazellen spielt.
Sie fütterten Wildtyp-Mäuse mit intaktem FFA1 und weitere Tiere mit einer FFA1-Knockout-Mutation, und zwar 8 Wochen vor der Paarung sowie während der Trächtigkeit und der Laktationsperiode entweder mit einer fettreichen Kost oder mit Standard-Mäusefutter.
Fettreiche Kost lässt Blutzucker beim Nachwuchs ansteigen
Junge Mäuse, deren Elterntiere die FFA1-Knockout-Mutation aufgewiesen und normales Futter erhalten hatten, wiesen im Alter von 6 Tagen höhere Blutzuckerwerte auf als der Nachwuchs von ebenfalls mit normalem Futter ernährten Wildtyp-Elterntieren. Waren die Eltern dagegen mit der fettreichen Kost gefüttert worden, wies der Wildtyp-Nachwuchs an Tag 6 erhöhte Blutzuckerwerte auf.
Darüber hinaus war die Insulinantwort beim FFA1-Knockout-Nachwuchs beeinträchtigt. Im Vergleich zu den Nachkommen der FFA1-Knockout-Mäuse wurde die Insulinausschüttung der Betazellen durch einen Anstieg des Glukosespiegels bei den Wildtyp-Mäusen vier- bis fünfmal so stark stimuliert.
Neues Target zum Schutz vor mütterlicher Adipositas
Die Forschenden schlussfolgern, dass FFA1 erforderlich ist, damit junge Mäuse die Fähigkeit zu einer adäquaten Insulinantwort entwickeln und damit sie in der Lage sind, die Insulinausschüttung an metabolische Herausforderungen wie eine fettreiche Kost der Eltern anzupassen. Künftig könnte es möglich sein, den FFA1-Signalweg pharmakologisch so zu modulieren, dass die Effekte von mütterlicher Adipositas und/oder Gestationsdiabetes auf die Nachkommen abgemildert werden.
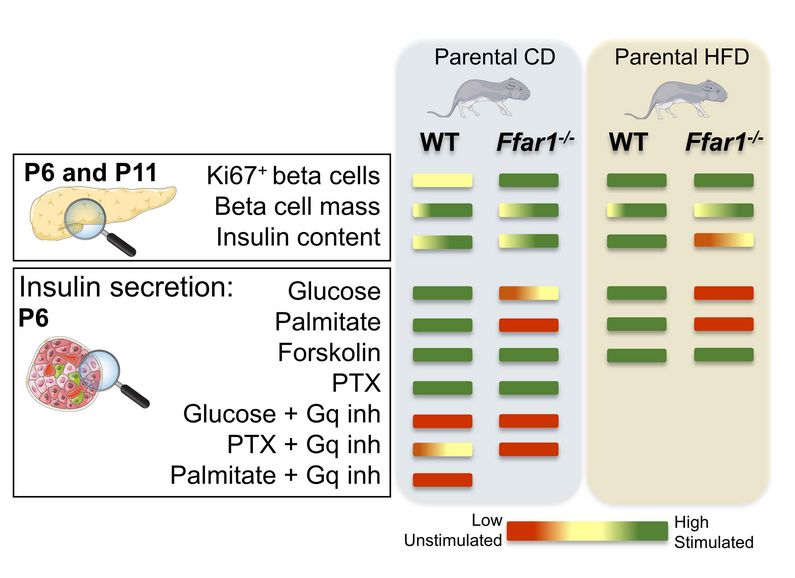
© Felicia Gerst (images from bioicons.com)
Original-Publikation:
Lorza‑Gil E, …, Gerst F. Glucose‑stimulated insulin secretion depends on FFA1 and Gq in neonatal mouse islets. Diabetologia, 2023. DOI: 10.1007/s00125-023-05932-5
Mechanismen entschlüsselt: AgRP-Neuronen kontrollieren Leberautophagie während Fastenphase
Nutrient-sensing AgRP neurons relay control of liver autophagy during energy deprivation.
Cell Metab 2023
Die Autophagie ist ein wesentlicher Regulator des Stoffwechsels. Forschende haben in einer aktuellen Arbeit detailliert untersucht, wie sich die Leberautophagie durch Nahrungsentzug verändert. Eine zentrale Rolle spielen die AgRP-Neuronen des Hypothalamus, die durch Energiemangel aktiviert werden.
Der Hypothalamus ist für die Regulation der Energiehomöostase wichtig. Spezielle Neuronen empfangen hierfür hormonelle, neuronale und ernährungsphysiologische Signale. Zu ihnen gehören AgRP-Neuronen (Agouti-Related Peptid), die metabolische Signale erkennen und integrieren. Das trägt dazu bei, die Nahrungsaufnahme und den Energieaufwand zu regulieren und die Glukosehomöostase zu erhalten.
AgRP-Neuronen induzieren hepatische Autophagie
Ein Team um den assoziierten Partner des DZD, Prof. Jens Brüning vom Max-Planck-Institut für Stoffwechselforschung in Köln, fand nun heraus, dass eine Fastendiät in Mäusen AgRP-Neuronen im Hypothalamus aktiviert. Das wiederum induzierte eine Autophagie in der Leber und förderte die Ketogenese.
Die Autophagie ist ein zellautonomer Prozess, durch den zytosolische Komponenten wie Proteine, Lipide und Nukleinsäuren für den Abbau zu Lysosomen transportiert werden. Dadurch wird die zelluläre Homöostase aufrechterhalten und es werden metabolische Substrate für die Energieproduktion während eines Nahrungsentzugs bereitgestellt. Weitere Experimente ergaben, dass die durch die AgRP-Neuronen induzierte hepatische Autophagie von einer Neuropeptid Y (NPY)-Freisetzung im paraventrikulären Nukleus des Hypothalamus (PVH) abhängt und PVHCRH-Neuronen aktiviert.
„Die Aktivierung der AgRP-Neuronen erhöhte die Konzentration zirkulierender Kortikosteroide“, erläutert DZD-Wissenschaftler Prof. Dr. Jens Claus Brüning. Wurde die Expression des hepatischen Glukokortikoidrezeptors verringert, schwächte das die AgRP-Neuronen-abhängige Aktivierung der hepatischen Autophagie. Sobald die Forschenden die AgRP-Neuronen während einer Energiedeprivation inhibierten, stoppte das die hepatische Autophagie.
Anpassung an den negativen Energiestatus
Auf Basis der Ergebnisse ergibt sich folgender Mechanismus: Während einer kurzzeitigen Fastenphase setzen AgRP-Neuronen NPY frei und fördern so einen Neuronenschaltkreis zur Aktivierung von PVHCRH-Neuronen. Das aktiviert seinerseits die Hypothalamus-Hypophysen-Nebennieren-Achse und die Glukokortikoid-Freisetzung, die wiederum die hepatische Autophagie kontrolliert.
Das ermöglicht eine Anpassung an den negativen Energiestatus. „Die Ergebnisse tragen dazu bei, das regulatorische Prinzip der Leberautophagie in der Kontrolle der Stoffwechselanpassung während eines Nahrungsentzugs besser zu verstehen“, sagt Brüning.
Original-Publikation:
Weiyi Chen, Oliver Mehlkop , Alexandra Scharn, Hendrik Nolte, Paul Klemm, Sinika Henschke, Lukas Steuernagel, Tamara Sotelo-Hitschfeld, Ecem Kaya, Claudia Maria Wunderlich, Thomas Langer, Natalia L Kononenko, Patrick Giavalisco & Jens Claus Brüning. Nutrient-sensing AgRP neurons relay control of liver autophagy during energy deprivation. Cell Metab. 2023 May. doi: 10.1016/j.cmet.2023.03.019.
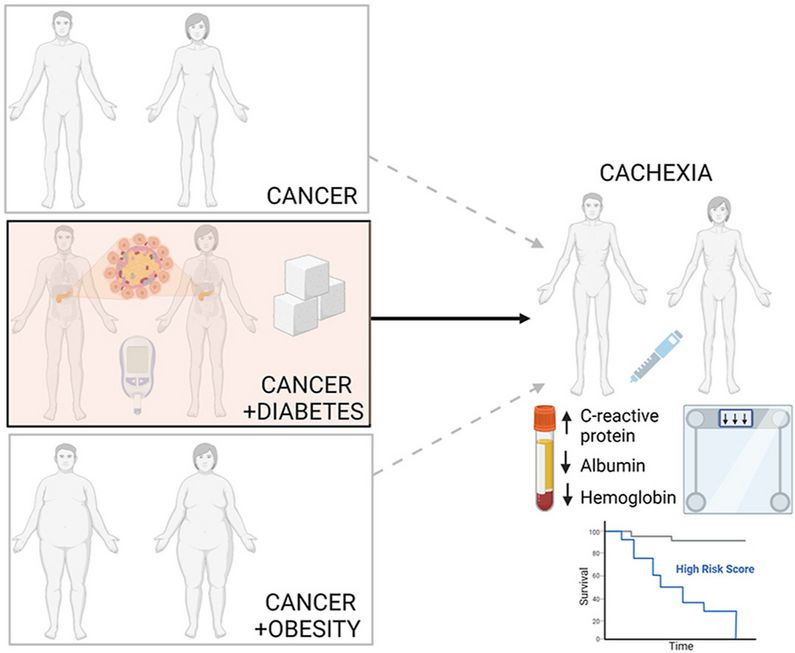
Darm- und Bauchspeicheldrüsenkrebs: Diabetes erhöht Kachexierisiko
Diabetes increases mortality in patients with pancreatic and colorectal cancer by promoting cachexia and its associated inflammatory status.
Mol Metab 2023
Patient:innen mit Darm- oder Bauchspeicheldrüsenkrebs haben ein erhöhtes Kachexie-Risiko, wenn sie zugleich an Diabetes erkrankt sind. Der Verlust von Fettgewebe und Skelettmuskultur ist bei ihnen häufiger – und stärker ausgeprägt. Auch die Überlebenswahrscheinlichkeit sinkt. Das zeigt eine im Fachblatt ‘Molecular Metabolism’ veröffentlichte Studie unter Beteiligung des Deutschen Zentrums für Diabetesforschung (DZD).
Krebs wird zunehmend als diabetische Komplikation eingestuft, da er bei Diabetespatient:innen häufiger auftritt und die Prognose verschlechtert. Und Krebspatient:innen wiederum entwickeln oft eine Kachexie. „Die krebsbedingte Kachexie könnte als neuartige Komplikation des Diabetes angesehen werden“, sagt Dr. Alexandra Chovsepian vom Institut für Diabetes und Krebs von Helmholtz Munich, eine der Erstautorinnen der Studie. „Diabetes sollte beim klinischen Management einer Kachexie gezielt berücksichtigt werden.“
Um herauszufinden, inwiefern Diabetes die Entstehung und Progression einer Kachexie beeinflusst, untersuchten Forschende vom DZD und von Partnerinstituten retrospektiv eine Kohorte von 345 Patientinnen und Patienten mit Darm- oder Bauchspeicheldrüsenkrebs.
Stärkerer Gewichtsverlust, geringere Überlebenswahrscheinlichkeit
Sie stellten fest, dass eine Vorerkrankung an Typ-2-Diabetes bei den Krebspatient:innen mit einer erhöhten Kachexie-Inzidenz verbunden war. Insgesamt entwickelten 80 Prozent von ihnen eine Kachexie. Bei den Patient:innen ohne Diabetes waren es nur rund 60 Prozent.
Die diabeteskranken Krebspatient:innen verloren unabhängig von Ausgangsgewicht und Tumorprogression mehr Gewicht (8,9% vs. 6,0%) als diejenigen ohne Diabetes. Und auch ihre Überlebenswahrscheinlichkeit war geringer: Ohne Diabetes überlebten 50 Prozent der Patienten im Schnitt 689, mit Diabetes 538 Tage.
Patient:innen mit Bauchspeicheldrüsenkrebs entwickeln besonders oft eine Kachexie. In einer Subanalyse reduzierte ein Diabetes, wie auch in der Gesamtkohorte, das Überleben und sorgte für einen (noch) stärkeren Gewichtsverlust (9,95% vs. 6,93%). Zudem verlängert sich bei diesen Patient:innen die Hospitalisierungsdauer (24,41 vs. 15,85 Tage).
© Mol Metab / Alexandra Chovsepian (DOI: 10.1016/j.molmet.2023.101729)
Systemische Entzündung könnte „Auszehrung“ beschleunigen
Auch die Laborwerte zeigten Unterschiede: Bei den Krebspatient:innen mit Diabetes waren C-reaktives Protein (CRP) und Interleukin-6 höher und Serum-Albumin niedriger als bei denjenigen ohne Diabetes. Bei den kachektischen Krebspatient:innen mit Diabetes waren die Veränderungen besonders ausgeprägt: So stieg bei ihnen zum Beispiel das C-reaktive Protein bis auf 2,300 μg/ml an, während es bei den nicht-diabetischen Patient:innen bei 0,808 μg/ml lag.
„Die signifikant erhöhten CRP-Level, aber auch andere Entzündungsparameter wie der Blutplättchen -Lymphozyten-Quotient weisen bei den Patient:innen mit Diabetes und Kachexie auf eine stärkere systemische Inflammation hin“, erklärt Dr. Olga Prokopchuk aus der Klinik und Poliklinik für Chirurgie des Klinikums rechts der Isar, eine der Erstautorinnen der Studie. „Diese könnte die systemische Stoffwechselstörung antreiben und die Kachexie noch beschleunigen.“
Originalpublikation:
Alexandra Chovsepian, Olga Prokopchuk, Gabriela Petrova, Tefta Gjini, Hanna Kuzi, Simone Heisz, Klaus-Peter Janssen, Marc E. Martignoni, Helmut Friess, Hans Hauner & Maria Rohm. Diabetes increases mortality in patients with pancreatic and colorectal cancer by promoting cachexia and its associated inflammatory status. Mol Metab 2023 Apr 22; doi.org/10.1016/j.molmet.2023.101729
Adipositas-Chirurgie senkt Wachstumshormon-Spiegel durch verbesserte Funktion des Fettgewebes
Metabolic surgery-induced changes of the growth hormone system relate to improved adipose tissue function.
International Journal of Obesity 2023
Ein Gewichtsverlust durch bariatrische Operationen kann neben der Insulinresistenz auch die Fettgewebsfunktion verbessern. Anhand der Stoffwechselprofile von Patient:innen zeigten Forschende erstmals, dass Änderungen des Wachstumshormon-Spiegels und des insulinähnlichen Wachstumsfaktors 1 (IGF-1) mit Verbesserungen der Fettgewebsfunktion korrelieren, aber nicht mit der Insulinsensitivität.
Im International Journal of Obesity haben Wissenschaftler:innen des DZD-Partners Deutsches Diabetes-Zentrum eine Analyse von 79 Adipositas-Patient:innen der BARIA-DDZ Studie veröffentlicht. Der Body Mass Index (BMI) der Teilnehmenden lag zu Beginn bei 50,8 ± 6,3 kg/m2. Sie wurden per Schlauchmagen-Operation (n=30) oder per Magenbypass-Operation (n=49) behandelt. Postoperative Untersuchungen folgten 2, 12, 24 und 52 Wochen nach dem Eingriff. Eine Kontrollgruppe mit 24 gesunden, schlanken Probanden (BMI 24,3 ± 3,1 kg/m2) lieferte Vergleichsdaten.
Höhere Glykämie und Leptinämie zu Studienbeginn
Zu Beginn der Studie wiesen Personen mit Adipositas im Vergleich zu normalgewichtigen Personen höhere Blutglukose- und Leptin-Spiegel auf. Ihre Muskel-, Fettgewebs- und Leber-Insulinresistenz war stärker ausgeprägt als in der Kontrollgruppe. Die Spiegel des Wachstumshormons (GH) und des IGF-bindenden Proteins (IGFBP1) waren niedriger. Hingegen war der Spiegel des IGF-1 in beiden Gruppen vergleichbar.
52 Wochen nach der OP hatten Patient:innen der Adipositas-Gruppe 33 Prozent ihres Körpergewichts verloren und ihre Muskel-Insulinempfindlichkeit verdoppelt. Dies ging mit einem kontinuierlichen Anstieg von GH, IGF-1 und IGFBP1 sowie einem Rückgang von Leptin einher.
- Der Anstieg von GH korrelierte mit einer Verringerung des Spiegels freier Fettsäuren, der Insulinresistenz des Fettgewebes und des Insulin-Spiegels im Blut, jedoch nicht mit Veränderungen des Körpergewichts, der peripheren Insulinempfindlichkeit, der Glykämie oder der Leptinämie.
- Der Anstieg von IGF-1 wiederum korrelierte mit einer Verringerung des Spiegels des C-reaktiven Proteins, einem wichtigen Entzündungs-Marker.
„Die Veränderungen von GH und IGF-1 nach einer chirurgisch induzierten Gewichtsabnahme hängen wahrscheinlich nicht mit einer verbesserten Leptinsekretion oder Insulinsensitivität zusammen, sondern eher mit einer wiederhergestellten Funktion des Fettgewebes und einer Verbesserung der subklinischen Inflammation“, fasst Erstautorin Sofiya Gancheva die Ergebnisse zusammen.
Original-Publikation:
Sofiya Gancheva, Sabine Kahl, Christian Herder, Klaus Straßburger, Theresia Sarabhai, Kalliopi Pafili, Julia Szendroedi, Matthias Schlensak & Michael Roden. Metabolic surgery-induced changes of the growth hormone system relate to improved adipose tissue function. International Journal of Obesity 23 Mar 2023, https://doi.org/10.1038/s41366-023-01292-7
Junge Menschen mit Typ-1-Diabetes: Weniger Komplikationen mit Glukosesensor
Continuous glucose monitoring versus blood glucose monitoring for risk of severe hypoglycaemia and diabetic ketoacidosis in children, adolescents, and young adults with type 1 diabetes: a population-based study.
The Lancet Diabetes & Endocrinology 2023
Junge Menschen mit Typ-1-Diabetes, die zur Glukosemessung die kontinuierliche Glukosemessung mit einem Glukosesensor einsetzen, haben weniger akute, schwere Komplikationen. Das zeigt eine Studie unter Beteiligung des Deutschen Zentrums für Diabetesforschung (DZD).
Mit einem gut eingestellten Blutzucker entwickeln Menschen mit Diabetes seltener mikro- und makrovaskuläre Komplikationen. Aber auch akute Komplikationen wie schwere Hypoglykämien und diabetische Ketoazidosen gilt es zu vermeiden. Und das funktioniert mit einer kontinuierlichen Glukosemessung (CGM) mittels Glukosesensor bei jungen Menschen mit Typ-1-Diabetes offenbar besser als mit herkömmlicher Blutzuckermessung
In der in Lancet Diabetes & Endocrinology veröffentlichten Studie analysierten Forscher:innen die Daten von mehr als 32.000 Typ-1-Diabetes-Patient:innen im Alter von 1,5 bis 25 Jahren aus Österreich, Deutschland, Luxemburg und der Schweiz. Von ihnen verwendeten 34% einen Glukosesensor zur CGM und 66% bestimmten ihren Blutzucker per Fingerprick-Test selbst.
“Wir stellten fest, dass die jungen Patient:innen mit Typ-1-Diabetes seltener eine schwere Hypoglykämie oder eine diabetische Ketoazidose entwickelten, wenn sie einen Glukosesensor verwendeten“, berichtet Prof. Beate Karges von der Sektion Endokrinologie und Diabetologie an der Uniklink der RWTH Aachen.
Schwere Hypoglykämien und diabetische Ketoazidosen seltener
Im Vergleich zu Patient:innen mit Blutzuckermessung per Fingerprick-Test hatten Patient:innen mit Glukosesensor 0,76-mal seltener eine schwere Hypoglykämie und 0,51-mal seltener eine diabetische Ketoazidose.
CGM-System liefert Daten zu Risikoparametern
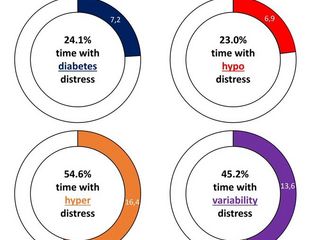
Die DZD-Forscher:innen untersuchten außerdem, ob bestimmte Messwerte, die das CGM-System liefert, mit dem Risiko für akute Komplikationen in Zusammenhang stehen. So entdeckten sie, dass Patient:innen, deren Glukosewert mehr als 8% der Zeit unterhalb des Zielbereichs lag, ein um das 2,38-Fache höheres Risiko für das Auftreten schwerer Hypoglykämien hatten.
Lag außerdem die glykämische Variabilität über 36%, kam es ebenfalls häufiger zu schweren Hypoglykämien. Im Gegensatz dazu waren die Raten an diabetischen Ketoazidosen erhöht, wenn die vom Glukosesensor gemessenen durchschnittlichen Glukosewerte über 180 mg/dl lagen.
CGM kann vor akuten diabetischen Komplikationen schützen
„Unsere Ergebnisse zeigen, dass CGM dazu beitragen kann, junge Patient:innen mit Typ-1-Diabetes vor akuten diabetischen Komplikationen zu schützen“, sagt Karges. „Sie könnte außerdem dabei helfen, diejenigen Patienten zu identifizieren, die das höchste Risiko für solche Komplikationen haben, um ihnen dann eine personalisierte Therapie anbieten zu können.“
In einem Editorial kommentieren Dr. Alfonso Galderisi und Prof. Jennifer L Sherr, Spezialist:innen für pädiatrische Endokrinologie an der Yale University, New Haven, USA: „Die Ergebnisse dieser Studie sprechen eindeutig dafür, dass diese Technologie dabei helfen kann, das Risiko für akute diabetische Komplikationen abzumildern.“ Die Identifikation von CGM-Grenzwerten erlaube es, sich speziell um die Kinder und Jugendlichen zu kümmern, die das höchste Risiko für akute Komplikationen hätten.
Original-Publikation:
Karges B, ...., Holl RW. Continuous glucose monitoring versus blood glucose monitoring for risk of severe hypoglycaemia and diabetic ketoacidosis in children, adolescents, and young adults with type 1 diabetes: a population-based study. Lancet Diabetes Endocrinol 2023 Mar 30; https://doi.org/10.1016/S2213-8587(23)00061-X
Editorial:
Galderisi A & Sherr JL. Answering clinically pertinent questions with real-world data from paediatric type 1 diabetes registries. Lancet Diabetes Endocrinol 2023 Mar 30; https://doi.org/10.1016/S2213-8587(23)00085-2
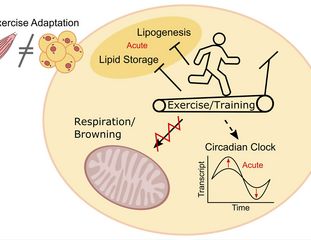
Sport fördert Diabetesvorbeugung im Fettgewebe
Acute and long-term exercise adaptation of adipose tissue and skeletal muscle in humans: a matched transcriptomics approach after 8-week training-intervention.
International Journal of Obesity 2023
Regelmäßiger Sport reduziert das Risiko für Typ-2-Diabetes. Eine Studie des Deutschen Zentrums für Diabetesforschung (DZD) hat untersucht, welche Rolle die Skelettmuskulatur und das subkutane Fettgewebe für die gesundheitsfördernden Effekte durch Sport spielen.
Die Ergebnisse der im International Journal of Obesity veröffentlichten Studie zeigen, dass auch das subkutane Fettgewebe eine entscheidende Rolle bei der Vorbeugung von Stoffwechselerkrankungen spielt – obwohl es ganz anders auf Sport reagiert als das Muskelgewebe.
Anpassungen auf molekularer Ebene
„Wir konnten zeigen, dass es durch körperliche Aktivität im subkutanen Fettgewebe zu Anpassungen auf molekularer Ebene kommt, die mit der Lipidspeicherung und Lipogenese, aber auch mit dem zirkadianen Rhythmus assoziiert sind. Diese könnten einem Fortschreiten des metabolischen Syndroms zu Typ-2-Diabetes entgegenwirken“, sagt DZD-Wissenschaftler Dr. Simon Dreher vom Universitätsklinikum Tübingen.
"Unter anderem kommt es bei adipösen Personen durch den Sport offenbar zur Wiederherstellung eines gesünderen, zirkadianen Rhythmus in den Zellen des Fettgewebes, wenn sie regelmäßig trainieren“, so Dreher.
An der Studie nahmen acht Frauen und sechs Männer teil, die einen vorwiegend sitzenden Lebensstil pflegten und Übergewicht oder Adipositas aufwiesen. Sie absolvierten ein 8-wöchiges überwachtes Ausdauertraining, bei dem sie dreimal pro Woche für eine Stunde trainierten – jeweils 30 Minuten Radfahren und 30 Minuten Laufband-Training. Vor und nach dem Training wurden Proben aus dem subkutanen Fettgewebe und der Skelettmuskulatur genommen, um Transkriptomanalysen durchzuführen.
Sport verändert Genexpression im Fettgewebe
Es zeigte sich, dass nach der ersten Sporteinheit im subkutanen Fettgewebe 37 Transkripte akut herunter- oder hochreguliert worden waren. Betroffen waren vor allem Transkripte von Genen, die mit dem Lipidmetabolismus und dem zirkadianen Rhythmus assoziiert sind.
Im Muskelgewebe veränderte sich nach der ersten Sporteinheit dagegen die Regulation von 394 Transkripten. „Eine Überlappung zwischen Fett- und Muskelgewebe gab es so gut wie gar nicht, was hervorhebt, wie unterschiedlich Fett- und Muskelgewebe auf körperliche Aktivität reagieren“, sagt Prof. Cora Weigert, verantwortliche Autorin der Studie. „Diese Anpassungen im Transkriptom scheinen zudem langfristig zu sein, sie waren auch nach dem 8-wöchigen Trainingsprogramm zu beobachten.“
Ein Anstieg der mitochondrialen Atmung, wie sie bei körperlicher Aktivität in der Skelettmuskulatur zu beobachten ist, war im subkutanen Fettgewebe nicht nachweisbar. Auch eine Bräunung des Fettgewebes zeigte sich bei den Proband:innen nicht.
Die Veränderung von zirkadianem Rhythmus und Lipidstoffwechsel durch Sport trägt möglicherweise zu einem gesünderen Stoffwechsel und einem geringeren Risiko für Typ-2-Diabetes bei. Auch auf molekularer Ebene zu verstehen, wie körperliche Aktivität vor Typ-2-Diabetes schützt, könnte den Forscher:innen zufolge dabei helfen, bessere Strategien zur Diabetesprävention zu entwickeln
Original-Publikation:
Dreher SI, Irmler M, Pivovarova-Ramich O, Kessler K, Jürchott K, Sticht C, Fritsche L, Schneeweiss P, Machann J, Pfeiffer AFH, Hrabě de Angelis M, Beckers J, Birkenfeld AL, Peter A, Niess AM, Weigert C, Moller A. Acute and long-term exercise adaptation of adipose tissue and skeletal muscle in humans: a matched transcriptomics approach after 8-week training-intervention. International Journal of Obesity 2023;47: 313-324; https://doi.org/10.1038/s41366-023-01271-y
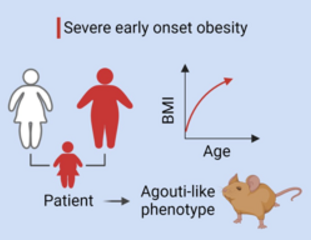
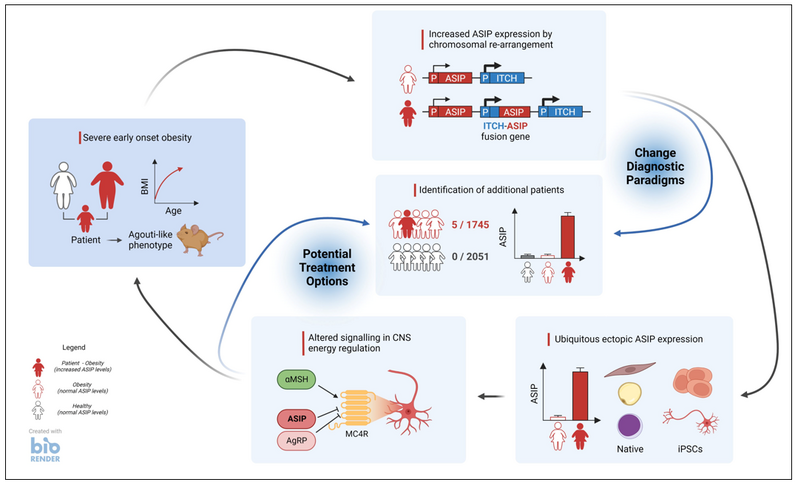
Frühe Adipositas: Forschende entdecken neue ursächliche Mutation
Aberrant expression of agouti signaling protein (ASIP) as a cause of monogenic severe childhood obesity.
Nature Metabolism 2022
Monogenetische Formen der Adipositas sind sehr selten. Jetzt haben Forschende einen neuen Mechanismus entdeckt, der mit starkem Übergewicht in Verbindung gebracht wird: eine Überexpression des sogenannten ASIP-Proteins. Über Details berichten sie in Nature Metabolism.
Ein Mädchen war bereits im Alter von zwei Jahren aufgrund von schwerem Übergewicht und Hochwuchs in ärztlicher Behandlung. Hinzu kamen später Anzeichen einer Insulinresistenz und einer hepatischen Steatose.
Beide Elternteile leiden an Adipositas. Der Vater hat Typ-2-Diabetes, Bluthochdruck und Gicht. In bestimmten äusseren Merkmalen wie der roten Haarfarbe, der blassen Haut und den Sommersprossen ähnelt das Mädchen seinem Vater. Klinisch relevante Varianten in Genen, die mit monogener Adipositas oder mit anderen Erbkrankheiten in Zusammenhang stehen, wurden durch eine Exom-Sequenzierung ausgeschlossen.
Allerdings deutet der Phänotyp einer früh einsetzenden extremen Adipositas mit starkem Längenwachstum, Hypopigmentierung und Veränderungen des Appetits auf eine genetische Ursache hin.
© Prof. Antje Körner, Universität Leipzig
Molekularbiologische Untersuchungen der stromal-vaskulären Fraktion
Deshalb haben die Forschenden eine Probe des subkutanen Fettgewebes der Patientin während einer bariatrischen Operation gewonnen. Sie suchten in Zellen der stromalen vaskulären Fraktion (SVF) mit Hilfe transkriptomweiter Analysen nach unterschiedlich exprimierten Genen im Vergleich zu SVF-Zellen von gesunden Kontrollen. Ein einzelnes Gen, das für ASIP (Agouti-Signaling Protein) kodiert, war in den Zellen der Patientin stark überexprimiert.
Die Wissenschaftler:innen fanden eine heterozygote Tandemduplikation am ASIP-Genlocus. Die Mutation stellt ASIP unter die Kontrolle eines ubiquitär aktiven Promotors, was zur verstärkten und ubiquitären Synthese des Agouti-Signaling Proteins führt, wie sie experimentell nachweisen konnten.
Phänotyp bekannt aus Mausmodellen
Der Phänotyp der Patientin ist überaus ähnlich dem bestimmter Mausmodelle, den sogenannten Agoutimäusen. ASIP unterdrückt als Antagonist die Aktivierung von Melanokortinrezeptoren (MCR), wie z.B. MC4R, was sich auf das Essverhalten, den Energieverbrauch, die Adipozyten-Differenzierung und die Pigmentierung auswirken könnte. Die Arbeitsgruppe hat die aberrante ASIP Expression in verschiedenen Zellen der Patientin nachgewiesen inklusive in induzierbaren Stammzellen, die sie u.a. in hypothalamisch-ähnliche Neuronen differenziert haben.
Da die Mutation bei den üblichen genetischen Screenings der Humanmedizin nicht entdeckt wird, haben Forschende die Leipziger Adipositas-Kohorte mit 1.745 Patienten erneut untersucht und vier weitere Patient:innen mit der identischen Mutation und mit ähnlichem Phänotyp identifiziert, was einer hohen Rate angesichts der Seltenheit monogen bedingter Adipositasformen entspricht.
Somit wurde erstmals eine genetisch bedingte Adipositasform beim Menschen entdeckt, die einem der ältesten Adipositasmausmodelle entspricht. Relevant ist diese Entdeckung nicht nur für die Erforschung der pathophysiologischen Zusammenhänge und Regelkreise der Adipositas beim Menschen, sondern auch, weil gendiagnostische Algorithmen überdacht werden müssen und es möglicherweise Behandlungsoptionen für diese Patienten gibt.
Original-Publikation:
Elena Kempf, Kathrin Landgraf, ..., Matthias Blüher & Antje Körner: Aberrant expression of agouti signaling protein (ASIP) as a cause of monogenic severe childhood obesity. Nature Metabolism, 2022. DOI: 10.1038/s42255-022-00703-9
Typ-2-Diabetes: Rolle der Sphingolipide entschlüsselt?
Sphingolipid subtypes differentially control proinsulin processing and systemic glucose homeostasis.
Nature Cell Biology 2023
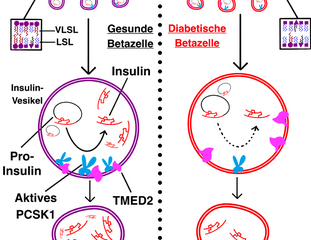
Die Umwandlung von Proinsulin zu Insulin in der Betazelle ist bei Menschen mit Diabetes beeinträchtigt. Forschende berichten in Nature Cell Biology über mögliche Ursachen: Darunter ein Funktionsverlust des CerS2-Enzyms, das für die Herstellung sehr langkettiger Sphingolipide benötigt wird.
Ein gestörter Stoffwechsel von Sphingolipiden wurde bereits zuvor mit Adipositas und Diabetes in Verbindung gebracht. Die Lipide sind für nahezu alle Zelltypen und Membranen wichtig – welche Funktionen sie in Betazellen (β-Zellen) einnehmen, ist bislang nicht bekannt.
Neue Erkenntnisse zeigen nun, dass Sphingolipide maßgeblich zur Proinsulin-Prozessierung beitragen können, wie Düsseldorfer, Kölner und Münchener Wissenschaftlerinnen und Wissenschaftler des Deutschen Zentrums für Diabetesforschung (DZD) unter anderem in Kollaboration mit Forschenden in der Schweiz und Belgien jetzt unter Leitung von Dr. Bengt-Frederik Belgardt vom Institut für Vaskular- und Inselzellbiologie am Deutschen Diabetes-Zentrum herausfanden.
Im Mausmodell für Typ-2-Diabetes beobachteten die Forschenden in den pankreatischen Betazellen eine Imbalance bestimmter langkettiger und sehr langkettiger Sphingolipide.
CerS2-Knockout verringert Insulinsekretion
Als Ursache dieses Ungleichgewichts kommt eine Verringerung der Aktivität der Ceramid-Synthase 2 (CerS2) in Frage. Das Enzym ist die häufigste Ceramid-Synthase in humanen Betazellen ohne Diabetes und wird benötigt, um sehr langkettige Sphingolipide (auch VLSL genannt) zu generieren. Fällt es aus, funktioniert dieser Prozess nicht mehr.
Der CerS2-Knockout in pankreatischen Betazellen von Mäusen führte zu einem verringerten Insulingehalt in den Betazellen, einer beeinträchtigten Insulinsekretion und einer gestörten Glukosetoleranz. Außerdem war das Verhältnis Insulin/Proinsulin reduziert, was für eine eingeschränkte Prozessierung von Proinsulin sprach.
Proinsulin-Prozessierung hängt von Sphingolipiden ab
Um den Mechanismen auf den Grund zu gehen, untersuchten die Wissenschaftlerinnen und Wissenschaftler verschiedene Proteininteraktionen. Sie identifizierten das Transportprotein Tmed2 als wichtiges Eiweiß während der Proinsulin-Umwandlung. Die Hypothese: Die Bindung von Sphingolipiden an Tmed2 fördert den Transport des Enzyms Pcsk1 zu den Insulin-sekretorischen Vesikeln.
Fehlt das CerS2-Enzym, beeinflusst das die Bindung der Sphingolipide an unter anderem Tmed2 sowie die Funktion des für die Proinsulin-Prozessierung notwendigen Enzyms Pcsk1. Die Ergebnisse könnten zum Teil die gestörte Umwandlung von Proinsulin zu Insulin erklären, die bei Typ-2-Diabetes beobachtet wird.
Original-Publikation:
Kerstin Griess, Michael Rieck, Nadine Müller, Gergely Karsai, Sonja Hartwig, Angela Pelligra, Robert Hardt, Caroline Schlegel, Jennifer Kuboth, Celina Uhlemeyer, Sandra Trenkamp, Kay Jeruschke, Jürgen Weiss, Leon Peifer-Weiss, Weiwei Xu, Sandra Cames, Xiaoyan Yi, Miriam Cnop, Mathias Beller, Holger Stark, Arun Kumar Kondadi, Andreas S. Reichert, Daniel Markgraf, Marianne Wammers, Dieter Häussinger, Oliver Kuss, Stefan Lehr, Decio Eizirik, Heiko Lickert, Eckhard Lammert, Michael Roden, Dominic Winter, Hadi Al-Hasani, Doris Höglinger, Thorsten Hornemann, Jens C. Brüning & Bengt-Frederik Belgardt: Sphingolipid subtypes differentially control proinsulin processing and systemic glucose homeostasis. Nature Cell Biology, 2023. DOI: 10.1038/s41556-022-01027-2
Bewegung senkt Risiko für Diabetes-Folgeerkrankungen
Physical Activity and Risk of Major Diabetes-Related Complications in Individuals With Diabetes: A Systematic Review and MetaAnalysis of Observational Studies.
Diabetes Care 2022
Körperliche Aktivität ist ein Eckpfeiler in der Diabetesbehandlung. Bisher gibt es aber nur wenige Erkenntnisse über den Zusammenhang zwischen körperlicher Aktivität und langfristigen diabetesbedingten Folgeerkrankungen. Forscher:innen des DZD-Partners Deutsches Diabetes-Zentrum haben in einer großen Metaanalyse herausgefunden, dass Bewegung mit einer geringeren Inzidenz von diabetesbedingten Komplikationen verbunden ist. Die Ergebnisse sind jetzt in Diabetes Care erschienen.
Die Forscher:innen haben prospektive Studien analysiert, die den Zusammenhang zwischen körperlicher Aktivität und dem Auftreten von diabetesbedingten Komplikationen, d. h. Herz-Kreislauf-Erkrankungen, koronare Herzkrankheiten, zerebrovaskuläre Ereignisse, Herzinsuffizienz, schwerwiegende unerwünschte kardiovaskuläre Ereignisse und mikrovaskuläre Komplikationen wie Retinopathie und Nephropathie, bei Personen mit Diabetes untersuchten. Insgesamt wurden 31 Studien eingeschlossen, die zwischen 1995 und 2021 veröffentlicht wurden, mit Untersuchung von Populationen in den USA, Europa, Asien und Australien sowie eine Kohorte aus 20 verschiedenen Ländern.
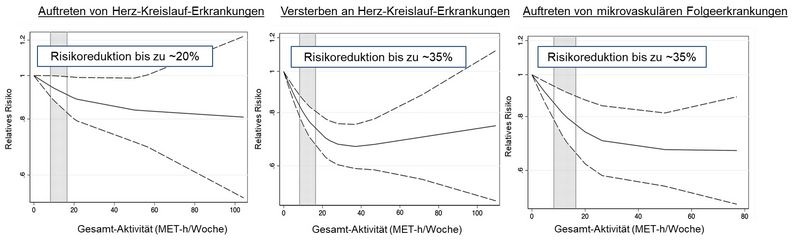
Abbildung: Risikoreduktion der Inzidenz und Mortalität von kardiovaskulären Erkrankungen sowie mikro-vaskulären Folgekomplikationen bei Personen mit Diabetes mellitus durch körperliche Aktivität bereits unterhalb der WHO-Empfehlung (grauer Bereich). Quelle: Diabetes Care. 2022;45(12):3101-3111. doi:10.2337/dc22-0886
Die Ergebnisse dieses Reviews einschließlich seiner Metaanalysen ergaben eine moderate Beweissicherheit dafür, dass körperliche Aktivität mit einem verringerten relativen Risiko für die Inzidenz und Mortalität von kardiovaskulären Erkrankungen sowie mit mikrovaskulären Gesamtkomplikationen, insbesondere Retinopathie, verbunden war. Die Auswertungen zeigen eine Dosis-Wirkungs-Beziehung, d.h. mit steigender körperlicher Aktivität sank das Risiko für Folgeerkrankungen des Diabetes.
Dosis-Wirkungs-Meta-Analysen zeigten, dass körperliche Aktivität auch bei niedrigeren Werten mit einem geringeren Risiko für diabetesbedingte Komplikationen verbunden war. Diese Ergebnisse deuten darauf hin, dass bereits ein körperliches Aktivitätsniveau, das unterhalb der WHO-Empfehlung liegt, das relative Risiko für diabetesbedingte Komplikationen verringert.
Original-Publikation:
Rietz M, Schlesinger S et al. Physical Activity and Risk of Major Diabetes-Related Complications in Individuals With Diabetes: A Systematic Review and MetaAnalysis of Observational Studies
Diabetes Care 2022;45(12):3101–3111; https://doi.org/10.2337/dc22-0886
Integrierte Versorgung von Diabetes und Depressionen in Indien ist kosteneffektiv
Cost-Effectiveness of a Collaborative Care Model Among Patients With Type 2 Diabetes and Depression in India.
Diabetes Care 2022
Eine integrative Behandlung von Menschen mit Typ-2-Diabetes und Depressionen in Indien trägt nicht nur zu einer besseren Versorgung der Patient:innen bei, sondern ist auch kosteneffektiv. Das zeigt eine aktuelle Studie mit DZD-Beteiligung. Die Ergebnisse wurden jetzt in Diabetes Care veröffentlicht.
Die Wissenschaftler:innen führten eine Kosten-Wirksamkeits-Analyse aus der Perspektive mehrerer Kostenträger und der Gesellschaft an vier städtischen Kliniken in Indien durch. In der randomisierten klinischen Studie wurden 404 Patienten mit schlecht eingestelltem Typ-2-Diabetes (HbA1c ≥8,0 %, systolischer Blutdruck ≥140 mmHg oder LDL-Cholesterin ≥130 mg/dL) und depressiven Symptomen (9-Punkte-Score im Patient Health Questionnaire ≥10) nach dem Zufallsprinzip entweder 12 Monate lang unter kooperativer Betreuung behandelt, bei der sie ein psychologisches Coaching durch nicht-ärztliche Pflegekoordinator:innen, elektronisches Management von Gesundheitsdaten und fachärztlich unterstützte Fallbesprechungen erhielten. Darauf folgten 12 Monaten mit einer herkömmlichen Behandlung. Oder die Patient:innen wurden 24 Monaten wie üblich betreut. Die Studie zeigte, dass die integrierte Versorgung nicht nur effektiv war (die klinischen Ergebnisse der INDEPENDENT Studie wurden 2020 in der Fachzeitschrift JAMA publiziert, https://jamanetwork.com/journals/jama/fullarticle/2769466), sondern auch kosten-effektiv sein kann. Dies ist insbesondere der Fall, wenn die integrierte Versorgung gut in den klinischen Alltag und dessen Abläufe integriert ist.
„Die Studie zeigt erstmalig, dass eine integrierte Versorgung in einem solchen Setting kosteneffektiv ist und dessen Implementierung zu einer besseren und effizienteren Versorgung von Diabetes und Depression in Indien beitragen kann“, fasst Erstautor Karl Emmert-Fees, die Ergebnisse der Studie zusammen. Basierend darauf können nun Modelle zur integrierten Versorgung für ähnliche Kontexte weiterentwickelt und implementiert werden. Gleichzeitig kann die Studie zur internationalen Leitlinienbildung hinsichtlich der Versorgung von Patient:innen mit nicht-übertragbaren Krankheiten und psychischen Komorbiditäten beitragen.
Im nächsten Schritt wollen die Forscher:innen die langfristigen Effekte der Intervention untersuchen. Außerdem soll identifiziert werden, welche Komponenten der integrierten Versorgung den größten Effekt auf die Gesundheit der Patient:innen und assoziierte Kosten haben.
Original-Publikation:
Karl M.F. Emmert-Fees, Michael Laxy, Shivani A. Patel, Kavita Singh, Subramani Poongothai, Viswanathan Mohan, Lydia Chwastiak, K.M. Venkat Narayan, Rajesh Sagar, Aravind R. Sosale, Ranjit Mohan Anjana, Gumpeny R. Sridhar, Nikhil Tandon, Mohammed K. Ali; Cost-Effectiveness of a Collaborative Care Model Among Patients With Type 2 Diabetes and Depression in India. Diabetes Care 2022; dc212533. DOi: https://doi.org/10.2337/dc21-2533
An der Studie waren beteiligt:
Institut für Epidemiologie, Helmholtz Munich, Professur für Public Health und Prävention, TU München, Emory Global Diabetes Research Center, Emory University Atlanta, (USA) Madras Diabetes Research Foundation (Indien)
Typ-1-Diabetes: Mehr gefährliche Stoffwechselentgleisungen bei Kindern in der COVID-19-Pandemie weisen auf ungelöstes Problem der frühzeitigen Diabetes-Diagnose hin
Impact of the COVID-19 pandemic on long-term trends in the prevalence of diabetic ketoacidosis at diagnosis of paediatric type 1 diabetes: an international multicentre study based on data from 13 national diabetes registries.
The Lancet Diabetes & Endocrinology 2022
Während der COVID-19-Pandemie haben deutlich mehr Kinder und Jugendliche bei der Diagnose eines Typ-1-Diabetes bereits eine diabetische Ketoazidose entwickelt als in den Vorjahren. Das ist das Ergebnis einer internationalen, multizentrischen Studie mit DZD-Beteiligung, die jetzt in Lancet Diabetes Endocrinol erschienen ist.
Haben Kinder und Jugendliche zum Zeitpunkt der Diagnose von Typ-1-Diabetes (T1D) bereits Stoffwechselentgleisungen (diabetische Ketoazidosen) entwickelt, kann dies zu Komplikationen wie längeren Krankenhausaufenthalten, einer schlechteren langfristigen Blutzuckereinstellung und Hirnödemen oder gar zu einer höheren Sterblichkeit führen. Während der COVID-19-Pandemie beobachteten Diabeteszentren weltweit eine erhöhte Prävalenz der diabetischen Ketoazidose bei der Diagnose von T1D. Forscher:innen des DZD untersuchten gemeinsam mit internationalen Kolleg:innen, ob die Zahl der diabetischen Ketoazidosen bei der Diagnose eines pädiatrischen T1D stärker gestiegen ist als zu erwarten war. Dazu analysierten sie die diabetischen Ketoazidosen vor und während der Pandemie.
Internationale multizentrische Studie
Das Team wertete die Daten 13 nationaler Diabetesregister aus (Australien, Österreich, Dänemark, Deutschland, Italien, Luxemburg, Neuseeland, Norwegen, Schweden, Slowenien, Tschechien, USA [Colorado] und Wales). Die Studienkohorte umfasste 104.290 Kinder und Jugendliche im Alter von 6 Monaten bis unter 18 Jahren, bei denen zwischen dem 1. Januar 2006 und dem 31. Dezember 2021 T1D diagnostiziert wurde. Die beobachtete Prävalenz der diabetischen Ketoazidose in den Jahren 2020 und 2021 wurde mit Vorhersagen verglichen, die auf Trends in den Jahren vor der Pandemie (2006-2019) basierten.
Prävalenz der diabetischen Ketoazidose stieg während der Pandemie stärker als erwartet
Von 2006 bis 2019 hatten 23.775 von 87 228 Kinder eine diabetische Ketoazidose bei der Diagnose von T1D (27,3 %). Der mittlere jährliche Anstieg der Prävalenz der diabetischen Ketoazidose in der Gesamtkohorte von 2006 bis 2019 betrug 1,6 %. Während der Pandemie lagen Zahlen deutlich über den vorhergesagten Prävalenzen. Im Jahr 2020 betrug die bereinigte beobachtete Prävalenz der diabetischen Ketoazidose 39,4 % (vorhergesagte Prävalenz 32,5 %) und 38,9 % im Jahr 2021 (vorhergesagte Prävalenz 33,0 %).
„Die steigende Prävalenz der diabetischen Ketoazidose bei der Diagnose von Typ-1-Diabetes bei Kindern ist ein globales Problem. Bereits vor der COVID-19-Pandemie hat sich Prävalenz erhöht. Während der Pandemie ist sie noch mal deutlich stärker gestiegen“, fasst DZD-Wissenschaftler Prof. Reinhard W. Holl von der Universität Ulm die Ergebnisse zusammen. Die Autor:innen der Studie weisen darauf hin, dass eine umfassende Aufklärung über die klassischen Symptome des T1D im Kindesalter in der breiten Öffentlichkeit, bei den in der Kinderbetreuung oder Tagespflege tätigen Personen und bei den Allgemeinärzten in der Primärversorgung helfen könnte, das Bewusstsein für die Symptome von T1D zu schärfen. Zudem könnten auch Maßnahmen des öffentlichen Gesundheitswesens genutzt werden, wie z. B. die Durchführung allgemeiner Screening-Programme für Inselautoantikörper bei Kindern, um die Zahl gefährlicher Stoffwechselentgleisungen zu senken.
Original Publikation:
Niels H Birkebaek…Reinhard W Holl, Ondrej Cinek et al.: Impact of the COVID-19 pandemic on long-term trends in the prevalence of diabetic ketoacidosis at diagnosis of paediatric type 1 diabetes: an international multicentre study based on data from 13 national diabetes registries. The Lancet Diabetes & Endocrinology, 2022. DOI: doi.org/10.1016/S2213-8587(22)00246-7.
Mehr Beinamputationen bei Menschen mit Diabetes im COVID-19-Pandemiejahr 2020
Hospitalisation rate and mortality among people with and without diabetes during the COVID-19 pandemic year 2020.
European Journal of Epidemiology 2022
Im Jahr 2020 waren weniger Menschen aufgrund einer koronaren Herzerkrankung, eines Herzinfarktes oder eines diabetischen Fußes im Krankenhaus als in den Vorjahren. Allerdings stieg die Zahl der Menschen mit Diabetes, die wegen einer Beinamputation (oberhalb des Fußknöchels) eingewiesen wurden, deutlich an. Das zeigt eine Untersuchung des DZD und des Deutschen Diabetes-Zentrums (DDZ) auf Basis von Daten einer deutschen gesetzlichen Krankenkasse. Die Ergebnisse der Studie sind jetzt im European Journal of Epidemiology erschienen.
Menschen mit Diabetes sind während der COVID-19-Pandemie seltener zu Ärzt:innen gegangen. Darauf deuten mehrere Studien hin. Gründe hierfür können die eingeschränkten medizinischen Leistungen und die Angst vor einer Ansteckung mit COVID-19 sein. Forscher:innen des DDZ und DZD haben analysiert, wie die Hospitalisierung und Sterblichkeit von Menschen mit und ohne Diabetes in Deutschland während des COVID-19-Pandemiejahres 2020 im Vergleich zu 2017-2019 war. Dafür werteten sie die Daten einer deutschen gesetzlichen Krankenkasse aus, bei der 3,2 Millionen Menschen versichert sind.
Das Forscherteam schätzte die alters- und geschlechtsstandardisierten Raten von Sterblichkeit, Krankenhausaufenthalten gesamt sowie aufgrund von koronarer Herzerkrankung, akutem Herzinfarkt, Schlaganfall, diabetischem Fußsyndrom sowie von Beinamputationen und Amputationen unterhalb des Fußknöchels bei Menschen mit und ohne Diabetes. Die zu erwarteten Raten für das Jahr 2020 wurden mithilfe einer Poisson-Regression auf der Grundlage der Ergebnisse aus den Jahren 2017-2019 vorhergesagt und mit den beobachteten Raten verglichen. Dabei zeigte sich, dass die Hospitalisierungsrate für Beinamputation bei Menschen mit Diabetes deutlich erhöht war. Die Hospitalisierungsrate gesamt sowie aufgrund einer koronaren Herzerkrankung, eines Herzinfarktes oder wegen diabetischem Fußsyndrom war jedoch deutlich niedriger. Die Mortalität und die Hospitalisierungsrate wegen eines Schlaganfalls blieben dagegen nahezu unverändert.
Der Anstieg der Krankenhausaufenthalte aufgrund von Beinamputationen bei Menschen mit Diabetes bei gleichzeitigem Rückgang von Einlieferungen wegen des diabetischen Fußsyndroms bedarf besonderer Aufmerksamkeit, betonen die Autor:innen der Studie.
Original-Publikation:
Narres, M., Claessen, H., Kvitkina, T. … Icks, A. et al.: Hospitalisation rate and mortality among people with and without diabetes during the COVID-19 pandemic year 2020. Eur J Epidemiol 37, 587–590 (2022). doi.org/10.1007/s10654-022-00865-6
Unterschiedliche Entwicklung von Betazellen in diabetesresistenten und -anfälligen Mäusen
Heterogeneous Development of β-Cell Populations In Diabetes-Resistant and -Susceptible Mice.
Diabetes 2022
Der fortschreitende Funktionsverlust und das Versagen der Insulin-produzierenden Betazellen ist ein Kennzeichen des Typ-2-Diabetes (T2D). DZD-Forscher:innen konnten jetzt zeigen, dass diabetesresistente und -anfällige Mäuse unterschiedlich auf eine kohlenhydratreiche Nahrung reagieren. Die Genexpression der Betazellen der diabetesresistenten Mäuse veränderte sich dahingehend, dass sich ein schützendes Betazell-Cluster entwickelte. Bei zu Diabetes neigenden Mäusen führte eine fehlende Anpassung der Genexpression bei steigendem Blutzucker zu einer höheren metabolischen Belastung und zum Versagen der Betazellen. Die Studie ist in der Fachzeitschrift Diabetes erschienen.
Um die Mechanismen des Betazellverlusts bei T2D zu untersuchen, haben Forscher:innen des DZD eine Einzelzell-RNA-Sequenzierung von Langerhans-Inseln bei zwei fettleibigen Mäusestämmen durchgeführt, die sich in ihrer Diabetesanfälligkeit unterscheiden. Sowohl die diabetesanfälligen als auch die diabetesresistenten Mäuse besitzen sechs verschiedene Gruppen von Beta-Zellen in ihren Inseln, die vor der Behandlung in ganz ähnlichen Verhältnissen vorkommen. Nach zweitägiger Fütterung einer kohlenhydratreichen diabetogenen Diät unterschied sich die Zusammensetzung der Betazell-Cluster zwischen den Stämmen jedoch deutlich. Die Inselzellen der diabetesresistenten Mäuse entwickelten sich zu einem schützenden Betazell-Cluster (Beta4). Dieses schützende Cluster zeigte Anzeichen einer reduzierten Betazell-Identität (wie z. B. die Herunterregulierung der Gene GLUT2, GLP1R und MafA). Merkmale reifer Beta-Zellen nahmen ab. Dies führt wahrscheinlich dazu, dass sie weniger Glukose aufnehmen und einige von ihnen sogar die Fähigkeit erlangen sich zu teilen, um letztendlich mehr Beta-Zellen zu produzieren. Ein in vitro Knockdown von GLUT2 in Betazellen führte zu geringeren Stressreaktionen und einer Abnahme von Apoptosemarkern (Apoptose = programmierter Zelltod). Dies könnte das verbesserte Überleben der Betazellen in diabetesresistenten Mäusen erklären.
Im Gegensatz dazu reagierten Betazellen von zu Diabetes neigenden Mäusen mit Expressionsänderungen, die auf metabolischen Druck und Stress im endoplasmatischen Retikulum hinweisen. Außerdem fehlte ihnen die Anpassung der Genexpression in Richtung eines stärker entdifferenzierten Zustands. Dies kann vermutlich zu einem späteren Verlust der Betazellen beisteuern, welcher wiederum zur Entwicklung eines Diabetes beiträgt.
„Unsere Studie liefert neue Hinweise darauf, warum Fettleibigkeit nicht immer zu einem Typ-2-Diabetes führt. Die Fähigkeit von Mäusen und vermutlich auch von Menschen, auf erhöhte Blutglukosekonzentrationen mit einer vorübergehenden Verringerung ihrer Beta-Zell-Identität zu reagieren, scheint eine Schlüsselrolle zu spielen, um sie vor Funktionsverlust und/oder Zelltod zu schützen,“ meint die für die Studie verantwortliche Autorin Annette Schürmann.
Zu der Studie:
An der Studie unter der Federführung des Deutschen Institut für Ernährungsforschung Potsdam-Rehbrücke (DIfE) waren Forscher:innen des Deutschen Zentrums für Diabetesforschung, von Helmholtz Munich und des Universitätsklinikums Carl Gustav Carus und der Medizinischen Fakultät der TU Dresden beteiligt.
Original-Publikation:
Gottmann P, ..., Schürmann A.: Heterogeneous Development of β-Cell Populations In Diabetes-Resistant and -Susceptible Mice. Diabetes. 2022 Jun 30:db211030. doi: 10.2337/db21-1030. Online ahead of print. PMID: 35771990
Diabetes-Subtypen bei Kindern und Jugendlichen
A classification and regression tree analysis identifies subgroups of childhood type 1 diabetes.
eBioMedicine 2022
Auch beim Kinder- und Jugend-Diabetes gibt es verschiedene Subtypen. In einer Studie mit DZD-Beteiligung konnten jetzt zehn verschiedene Subgruppen des Diabetes bei jungen Menschen identifiziert werden; darunter sieben Gruppen bei Patient:innen mit Insel-Autoantikörper-positivem Typ-1-Diabetes (Autoimmunerkrankung) sowie drei Insel-Autoantikörper-negative Subgruppen. Die neuen Erkenntnisse könnten künftig eine präzisere Diabetes-Prognose und -Therapie ermöglichen.
Typ-1-Diabetes (T1D) ist die häufigste Stoffwechselerkrankung bei Kindern und Jugendlichen. Weltweit haben ca. 1,1 Mio. junge Menschen diese Autoimmunerkrankung. Beim T1D bildet der eigene Körper Antikörper gegen die Insulin-produzierenden Betazellen (sog. Insel-Autoantikörper) und zerstört diese. Seltener sind in dieser Altersgruppe andere Formen wie MODY-Diabetes oder der Typ-2-Diabetes, bei dem das Hormon Insulin weniger gut wirkt (sinkende Insulin-Sensitivität). Um den jeweiligen Diabetes richtig behandeln zu können, ist eine genaue Diagnose nötigt. Doch nicht immer lassen sich die Diabetes-Formen anhand des klinischen Bildes und der biochemischen Werte eindeutig unterscheiden. Die Bestimmung von Insel-Autoantikörpern und die Erfassung zusätzlicher Parameter wie Betazell-Funktion und Insulin-Sensitivität sowie genetische Untersuchungen können helfen, zwischen autoimmunen und nicht-autoimmunen Formen des Diabetes zu unterscheiden. Bislang war noch nicht geklärt, ob es auch beim T1D ähnlich wie beim Typ-2-Diabetes verschiedene Subtypen gibt. Studien deuten darauf hin, dass es Unterschiede gibt, je nachdem in welchem Alter die Erkrankung auftritt. So variieren u.a. die genetische Belastung, die funktionelle Betazell-Reserve sowie die T- und B-Zell-Reaktionen auf Autoantigene mit dem Alter bei Diabetesbeginn. Zudem sprechen die Patient:innen je nach Alter beim Ausbruch der Erkrankung auch unterschiedlich auf eine Therapie an.
Ziel der aktuellen Studie war es, mit Hilfe eines multivariablen Ansatzes klinisch relevante Untergruppen des autoimmunen und nicht-autoimmunen Diabetes zu identifizieren. Dazu wurde bei Kindern und Jugendlichen unter 20 Jahren mit einem neudiagnostizierten Diabetes nach Parametern gesucht, die eine Gruppierung der Patient:innen hinsichtlich der C-Peptid-Konzentration im Blut ermöglichen. Das C-Peptid ist ein Indikator, dass noch Insulin gebildet wird (Restfunktion der Beta-Zellen).
Die Forschenden haben zehn Subgruppen identifiziert: sieben Insel-Autoantiköper-positive (Autoimmunerkrankung) und drei Insel-Autoantiköper-negative. Parameter für die Gruppierung waren das Alter, der HbA1c-Wert (Langzeitzuckerwert im Blut) und der Body-Mass-Index (BMI). Mit biochemischen Messungen erfolgte eine weitere Charakterisierung der Patient:innen. Zwischen den Gruppen gab es erhebliche Differenzen bezüglich C-Peptid, Genetik, Entzündungsmarkern, Diabetes-Familienanamnese, Lipiden, 25-OH-Vitamin D3, Insulin-Behandlung, Insulin-Sensitivität und Insulin-Autoimmunität. So konnten die Untersuchten in verschiedene Untergruppen mit potenziell unterschiedlichen Diabetes-Entwicklungen und -Prognosen unterteilt werden.
In den Subgruppen der jüngsten Insel-Autoantikörper-positiven Kinder und der Proband:innen mit den niedrigsten C-Peptid-Werten waren die Entzündungswerte (Interferon-ɣ- und/oder Tumornekrosefaktor-Profile) und Insulin-Autoimmunität besonders hoch. Die Subgruppen älterer Insel-Autoantikörper-positiver Kinder und Jugendlicher mit höheren C-Peptid-Werten wiesen Merkmale auf, die eher auf Typ-2-Diabetes (T2D) hinweisen, wie geringere Insulin-Sensitivität oder hoher BMI. Bei den Studien-Teilnehmenden ohne Insel-Autoantikörper ergaben sich Subgruppen mit Werten, die typischer für T2D oder MODY-Diabetes sind, aber auch welche mit Typ-1-Diabetes-Merkmalen.
Die Studie umfasste eine repräsentative Kohorte von 1.192 Kindern und Jugendlichen sowie eine weitere unabhängige mit 2.722 Proband:innen unter 20 Jahre mit neudiagnostiziertem Diabetes. Es zeigte sich, dass die definierten Subgruppen prognostische Bedeutung hatten. Bei Proband:innen der jeweiligen Subgruppen wurden noch nach sieben Jahren Unterschiede im HbA1c-Wert wie kurz nach der Diabetesmanifestation nachgewiesen.
Original-Publikation:
Achenbach et al.: A classification and regression tree analysis identifies subgroups of childhood type 1 diabetes. eBioMedicine, 2022, 82, 104118.
Studie zur psychosozialen Belastung bei Typ-1-Diabetes
Time With Diabetes Distress and Glycemia-Specific Distress: New Patient-Reported Outcome Measures for the Psychosocial Burden of Diabetes Using Ecological Momentary Assessment in an Observational Study.
Diabetes Care 2022
Viele Menschen mit Diabetes leiden auch psychisch unter ihrer chronischen Erkrankung. Zum „Diabetes-Distress“ zählen u.a. eine erhöhte Diabetesbelastung und auch Depression. In einer Beobachtungsstudie haben DZD-Forschende die psychosoziale Belastung erfasst. Die Ergebnisse sind in Diabetes Care erschienen.
Um die Zeit mit Diabetes-Distress bei Menschen mit Typ-1-Diabetes zu erfassen, verwendeten die Forschenden das Bewertungs-Tool Ecological momentary assessment (EMA)*. Zusätzlich wurde das Diabetes-Management basierend auf kontinuierlicher Glukoseüberwachung (CGM) erfasst und in Beziehung zu den EMA-Bewertungen gesetzt.
In der Studie wurde die Diabetesbelastung von 178 Erwachsenen mit Typ-1-Diabetes untersucht, die vor kurzem ins Krankenhaus eingeliefert worden waren. Sie bewerten an 17 aufeinanderfolgenden Tagen in einer ambulanten Umgebung ihren Diabetes-Distress. Zusätzlich wurden die Teilnehmer:innen täglich zu ihrem Diabetesmanagement sowie zu Unterzuckerung (<70 mg/dL bzw. 3,9 mmol/L), zu hohen Blutzuckerwerte (>180 mg/dL zw.10 mmol/L]) und Blutzuckerschwankungen befragt.
Pro Person wurde der Prozentsatz der Tage mit erhöhter Belastung berechnet. Die Diabetespatient:innen verbrachten im Schnitt die Tage in einem Zustand von Diabetes-Disstress wie folgt: 54,6 ± 26,0 % in Hyperglykämie-Disstress (erhöhte Blutzuckerwerte) , 45,2 ± 27,5 % in Variabilitäts-Disstress (Glukoseschwankungen) und 23,0 ± 19,3 % in Hypoglykämie-Disstress (Unterzuckerung). Die EMA-abgeleiteten Assoziationen zwischen Diabetes Distress und glykämischen Ergebnissen wurden mit Fragebogen-abgeleiteten Assoziationen verglichen. Dabei zeigte sich, dass die mit EMA bewertete Zeit mit Distress einen komparativen Vorteil gegenüber einer fragenbogenbasierten Beurteilung von Diabetes-Distress hatte, die auf Basis der Assoziationen mit dem glykämischen Management der Probanden bestimmt worden waren.
*Ecological Momentary Assessment (EMA) ist eine Form des ambulanten Assessments, bei der wiederholt und alltagsnah Daten zu psychologischen Parametern gesammelt werden.
Orginal-Publikation:
Ehrmann, D., Schmitt, A. …. Kulzer, B. Hermanns, N. : Time With Diabetes Distress and Glycemia-Specific Distress: New Patient-Reported Outcome Measures for the Psychosocial Burden of Diabetes Using Ecological Momentary Assessment in an Observational Study. Diabetes Care 2022; dc212339. DOI: https://doi.org/10.2337/dc21-2339
App unterstützt Lebensstiländerungen nach Schwangerschafts-Diabetes
A novel smartphone app to change risk behaviors of women after gestational diabetes: A randomized controlled trial.
PLoS One 2022
Mütter, die während ihrer Schwangerschaft an Gestationsdiabetes (GDM) litten, haben ein erhöhtes Risiko später an Typ-2-Diabetes zu erkranken. Die richtige Lebensweise kann dieses Risiko deutlich vermindern. In einer randomisierten kontrollierten Studie wurde untersucht, ob die Smartphone App TRIANGLE bei der Lebensstiländerung helfen kann.
Nach der Geburt steht für viele Mütter die eigene Gesundheit meist erst an zweiter Stelle. Dabei wäre es gerade für Frauen, die einen Schwangerschaftsdiabetes hatten, wichtig, sich gesund zu ernähren, ausreichend zu bewegen und auch zu entspannen. Denn die richtige Lebensweise kann helfen, das Risiko zu senken, später einen Typ-2-Diabetes oder Herzkreislauf-Erkrankungen zu entwickeln. Forschende u.a. des Deutschen Zentrums für Diabetesforschung (DZD) haben die Smartphone-App TRIANGLE entwickelt, um bei der Änderung des Lebensstils zu unterstützen. In einer 6-monatigen multizentrischen, randomisiert-kontrollierten Studie wurde untersucht, ob TRIANGLE im Vergleich zur Standardversorgung Betroffenen bei der Änderung des Lebensstils hilft.
Die App wurde gut angenommen und von den meisten Nutzern als hilfreich angesehen. Allerdings konnte diese erste Studie nicht die Wirksamkeit der TRIANGLE-Intervention zeigen. Sie stützt aber die Weiterentwicklung und Erprobung von TRIANGLE und anderen App-Interventionen für Frauen nach GDM. Es konnten notwendige Anpassungen im Studiendesign identifiziert werden, um nicht-intensive Lebensstilinterventionen für diese Zielgruppe besser zu untersuchen.
Original-Publikation:
Potzel, A. … Lechner, A.: A novel smartphone app to change risk behaviors of women after gestational diabetes: A randomized controlled trial. PLoS One (April 2022). DOI: doi.org/10.1371/journal.pone.0267258
Covid-19 erhöht Risiko für Typ-2-Diabetes
Incidence of newly diagnosed diabetes after Covid-19.
Diabetologia 2022
Menschen, die an Covid-19 erkrankt waren, haben ein erhöhtes Risiko einen Typ-2-Diabetes zu entwickeln. Das ist das Ergebnis einer Untersuchung von DDZ, DZD und IQVIA, die jetzt in ‚Diabetologia‘ erschienen ist.
Studien zeigen, dass auch die menschliche Bauchspeicheldrüse ein Ziel des SARS-CoV-2 (Severe acute respiratory syndrome coronavirus type 2) -Virus sein kann. Nach einer Infektion wurden in den Betazellen weniger Insulin-Granula sowie eine verminderte glukosestimulierte Insulin-Ausschüttung beobachtet. Zudem entwickelten einige Patienten nach einer Covid-19-Erkrankung eine Insulinresistenz und wiesen erhöhte Blutglukosewerte auf – ohne, dass sie vorher einen Diabetes hatten. Eine SARS-CoV-2-Infektion kann zu einer starken Ausschüttung von entzündungsfördernden Signalstoffen (Zytokinen) führen. Die Aktivierung des Immunsystems kann auch noch Monate nach einer SARS-CoV-2-Infektion anhalten und die Insulinwirksamkeit (Muskel, Fettzellen, Leber) beeinträchtigen.
Bislang ist jedoch unklar, ob diese Stoffwechselveränderungen vorübergehend sind oder ob eine Covid-19-Erkrankung das Risiko für einen anhaltenden Diabetes erhöht. Um diese Frage zu untersuchen, führten Forschende des Deutschen Diabetes-Zentrums (DDZ), Deutschen Zentrums für Diabetesforschung (DZD) und IQVIA (Frankfurt) eine retrospektive Kohortenstudie durch.
Die Kohortenstudie umfasste ein repräsentatives Panel von 1.171 Arztpraxen in ganz Deutschland (März 2020 bis Januar 2021: 8,8 Millionen Patienten). Die Nachbeobachtung ging bis Juli 2021. „Ziel unserer Studie war es, das Auftreten von Diabetes nach einer Infektion mit SARS-CoV-2 zu erforschen,“ sagt Erstautor Wolfgang Rathmann, Leiter der Forschungsgruppe Epidemiologie am DDZ. Als Kontrollgruppe wählten die Forschenden Menschen mit akuten Infektionen der oberen Atemwege (AURI), die ebenfalls häufig durch Viren verursacht werden. Die beiden Kohorten wurden hinsichtlich Geschlecht, Alter, Krankenversicherung, Monat der COVID-19- oder AURI-Diagnose und Komorbiditäten (Adipositas, Bluthochdruck, hoher Cholesterinspiegel, Herzinfarkt, Schlaganfall) gematcht. Patienten mit einer Steroidtherapie wurden zuvor ausgeschlossen.
Im Untersuchungszeitraum erkrankten 35 865 Menschen an Covid-19. „Unsere Auswertungen zeigten, dass Patienten mit Covid-19 im Vergleich zu Menschen mit AURI häufiger einen Typ-2-Diabetes entwickelten. Der Diabetes-Inzidenz betrug bei einer Covid-19-Infektion 15,8 im Vergleich zu 12,3 pro 1000 Personen pro Jahr bei AURI. Die statistische Auswertung ergab ein Inzidenzratenverhältnis (IRR) von 1,28. Einfach ausgedrückt bedeutet dies, dass das relative Risiko, an Typ-2-Diabetes zu erkranken, in der COVID-Gruppe um 28 % höher war als in der AURI-Gruppe“, fasst Rathmann die Ergebnisse zusammen.
Obwohl Typ-2-Diabetes für die überwiegende Mehrheit der Menschen mit leichter COVID-19-Erkrankung wahrscheinlich kein Problem darstellt, empfehlen die Autoren, dass jeder, der sich von COVID-19 erholt hat, auf die Warnzeichen und Symptome wie Müdigkeit, häufiges Wasserlassen und vermehrten Durst achten und sich sofort behandeln lassen sollte.
Original-Publikation:
Rathmann, W., Kuss, O. & Kostev, K.: Incidence of newly diagnosed diabetes after Covid-19. Diabetologia (2022). doi.org/10.1007/s00125-022-05670-0
Prädiabetes kann das Risiko für Komplikationen steigern
Prediabetes and risk of mortality, diabetes-related complications and comorbidities: umbrella review of meta-analyses of prospective studies.
Diabetologia 2022
Bereits die Vorstufe zum Typ-2-Diabetes erhöht das Risiko für schwerwiegende Folgeerkrankungen. Das zeigte eine Übersichtsarbeit des DZD-Partners Deutsches Diabetes-Zentrum.
Prädiabetes ist eine Vorstufe des Typ-2-Diabetes, bei der der Glukosestoffwechsel bereits gestört ist, aber die Glukose- oder HbA1c-Werte noch nicht hoch genug sind, um als Diabetes diagnostiziert zu werden. Studien der vergangenen Jahre deuten darauf hin, dass bereits diese Vorstufe mit chronischen Komplikationen und Folgeerkrankungen verbunden sein kann. In einem Umbrella-Review haben Forschende, einen systematischen Überblick über die bisherige Studienlage erstellt sowie deren Aussagekraft analysiert und bewertet.
Dazu haben die Forschenden 95 Meta-Analysen ausgewertet. Diese Meta-Analysen hatten prospektive Studien über Prädiabetes und dem Auftreten von diabetesbedingten Komplikationen, Komorbiditäten oder das Sterberisiko eingeschlossen, wenn sie die folgenden Zulassungskriterien erfüllten: Prädiabetes musste anhand von Blutzucker- oder HbA1c-Werten definiert werden, die über dem Normalwert lagen, aber nicht hoch genug waren, um als Diabetes diagnostiziert zu werden. Die Teilnehmer mussten Erwachsen sein (≥18 Jahre).
Die Ergebnisse zeigen, dass der Prädiabetes mit einem erhöhten Risiko für Folgeerkrankungen wie z. B. Herz-Kreislauf-Erkrankungen, Schlaganfällen, chronischer Nierenerkrankung, Demenz sowie Krebs und generell mit einer höheren Sterblichkeitsrate zusammenhängt. Prädiabetes ist somit gefährlicher als angenommen und verlangt erhöhte Aufmerksamkeit nicht nur durch die Wissenschaft, sondern auch in der klinischen Praxis. Die Sicherheit der Evidenz wurde anhand des GRADE-Tools bewertet. Die Ergebnisse werden als moderat-belastbar eingeschätzt, was bedeutet, dass die Befunde wahrscheinlich den wirklichen Zusammenhang widerspiegeln.
Die Forschenden weisen darauf hin, dass es noch weiterer qualitativ hochwertige Studien bedarf, insbesondere zu HbA1c-definiertem Prädiabetes und anderen relevanten Gesundheitsauswirkungen (z. B. Neuropathie), um die Erkenntnisse zu untermauern.

© DZD
Original-Publikation:
Schlesinger S, Neuenschwander M, Barbaresko J, Lang A, Maalmi H, Rathmann W, Roden M, Herder C. Prediabetes and risk of mortality, diabetes-related complications and comorbidities: umbrella review of meta-analyses of prospective studies. Diabetologia. 2022 Feb;65(2):275-285. doi: 10.1007/s00125-021-05592-3.
Typ-1-Diabetes-Inzidenz bei Kindern in der COVID-19-Pandemie gestiegen
Incidence of Type 1 Diabetes in Children and Adolescents During the COVID-19 Pandemic in Germany: Results From the DPV Registry.
Diabetes Care 2022
Während der COVID-19-Pandemie sind mehr Kinder und Jugendliche neu an Typ-1-Diabetes erkrankt als in den Vorjahren. Das zeigt eine aktuelle Studie des DZD, der Universität Gießen und der Universität Ulm mit Co-Autoren aus weiteren Zentren in Deutschland, die auf den Daten der multizentrischen Diabetes-Patienten-Verlaufsdokumentation (DPV*) basiert.
Ziel dieser Studie war es, das Auftreten von Typ-1-Diabetes bei Kindern und Jugendlichen während der COVID-19-Pandemie in Deutschland im Vergleich zu den Vorjahren zu untersuchen. Dazu erfassten die Forschenden für den Zeitraum vom 1. Januar 2020 bis zum 30. Juni 2021 die in Deutschland neuerkrankten Kinder und Jugendlichen im Alter zwischen sechs Monaten und unter 18 Jahren. In diesem Zeitraum wurden im DPV 5.162 Kinder und Jugendliche mit neu auftretendem T1D registriert. Das entspricht einer Inzidenz von 24,4 pro 100.000 Patientenjahre. Mithilfe von Poisson-Regressionsmodellen ermittelten die Forschenden aus den Daten der Jahre 2011 bis 2019 die erwarteten Inzidenzen für 2020/21 mit nur 21,2. Damit war die beobachtete Inzidenz während der Corona-Pandemie signifikant höher als die erwartete Inzidenz (24,4 [95% CI 23,6-25,2] vs. 21,2 [20,5-21,9]; Inzidenzratenverhältnisse (IRR) 1,15 [1,10-1,20]; P < 0,001).
Die Neuerkrankungen nahmen besonders zu in den Monaten Juni 2020 (IRR 1,43 [1,07-1,90]; P 5 0,003), Juli 2020 (IRR 1,48 [1,12-1,96]; P < 0,001), März 2021 (IRR 1,29 [1,01-1,65]; P 5 0,028) und Juni 2021 (IRR 1,39 [1,04-1,85]; P 5 0,010). „Die Inzidenzen des Typ-1-Diabetes stiegen mit einer Verzögerung von etwa drei Monaten nach den COVID-19-Inzidenz-Wellen sowie nach den Maßnahmen zur Eindämmung der Pandemie“, berichtet Letzt-Autor und DZD-Wissenschaftler Prof. Reinhard W. Holl von der Universität Ulm. Die zugrundeliegenden Ursachen für den Anstieg der T1D-Inzidenz sind allerdings noch unbekannt, betonen die Forschenden. Sie halten den Anstieg eher für eine indirekte Folge der Pandemie als direkt durch eine COVID-Infektion ausgelöst.
* Diabetes-Patienten-Verlaufsdokumentation (DPV):
Aktuell beteiligen sich mehr als 400 Behandlungseinrichtungen an der Diabetes-Patienten-Verlaufsdokumentation – vorwiegend aus Deutschland und Österreich, aber auch aus Luxemburg und der Schweiz. In der DPV sind Daten von mehr als 680.000 Patientinnen und Patienten erfasst. Ziel der DPV-Initiative ist es, die Behandlungsergebnisse für Menschen mit Diabetes in der Routinebetreuung durch standardisierte Dokumentation, objektiven Vergleich von Qualitätsindikatoren und durch multizentrische Therapieforschung zu verbessern.
Original-Publikation:
Kamrath, C. …. Holl, R. et al.: Incidence of Type 1 Diabetes in Children and Adolescents During the COVID-19 Pandemic in Germany: Results From the DPV Registry. Diabetes Care (2022) DOI: doi.org/10.2337/dc21-0969
Auswirkungen von Fettleibigkeit und Stoffwechselstörungen auf den Schweregrad von COVID-19- und Impfstoff-Durchbruchsinfektionen
Metabolic disorders, COVID-19 and vaccine-breakthrough infections.
Nature Reviews Endocrinology 2021
Fettleibigkeit und Stoffwechselstörungen sind wichtige Risikofaktoren für schwere COVID-19-Erkrankungen. Neue Daten deuten darauf hin, dass diese Risikofaktoren auch Impfdurchbrüche von SARS-CoV-2-Infektionen bei vollständig geimpften Personen begünstigen könnten. In einem Review-Artikel für ‘Nature Reviews Endocrinology’ fasst DZD-Forscher Norbert Stefan die wichtigsten Erkenntnisse über die Zusammenhänge von Adipositas, Diabetes und Herz-Kreislauf-Erkrankungen mit dem Schweregrad von COVID-19 und SARS-CoV-2-Impfdurchbrüchen zusammen.
Fettleibigkeit ist ein wichtiger Faktor für schwere COVID-19-Infektionen. Kürzlich veröffentlichte genetische Analysen der großen COVID-19 Host Genetics Initiative belegen, dass ein erhöhter Body-Mass-Index (BMI) ursächlich an der Entstehung der Krankheit beteiligt ist. Neue Daten aus einer sehr großen Kohortenstudie aus dem Vereinigten Königreich, in der Daten von 6 910 695 Patienten mit einem positiven SARS-CoV-2-Testergebnis ausgewertet wurden, ergaben, dass ein hoher BMI unabhängig von mehreren anderen COVID-19-Risikofaktoren, einschließlich Typ-2-Diabetes mellitus (T2DM), mit ungünstigen COVID-19-Ergebnissen verbunden war. Bei einem BMI >23 kg/m2 wurde ein linear erhöhtes Risiko einer Krankenhauseinweisung oder eines Todes aufgrund von COVID-19 beobachtet. Das Risiko für schwere COVID-19-Folgen in Verbindung mit einem erhöhten BMI ist in den jüngsten Altersgruppen (20-39 Jahre) am höchsten und nimmt mit zunehmendem Alter immer weiter ab.
Auch eine beschleunigte Immunoseneszenz (langsame Verschlechterung des Immunsystems bei älteren Menschen) könnte ein wichtiger Mechanismus sein, der die Beziehung zwischen Adipositas und T2DM mit schwerer COVID-19 erklärt. Neue Daten zeigen, dass hohe Glukosespiegel und Insulinresistenz, die bei Adipositas und T2DM häufig vorkommen, die adäquate Funktion von CD4+ und CD8+ T-Zellen beeinträchtigen. Das führt zu einer verminderten schützenden antiviralen Immunität. Darüber hinaus deuten neue Daten darauf hin, dass eine Insulinresistenz zu einer erhöhten Infektionsrate von Fettzellen und damit zu einer Progression von COVID-19 bei Menschen mit einer SARS-CoV-2-Infektion führen kann.
Während die Impfung gegen COVID-19 bei der Bekämpfung der COVID-19-Pandemie hochwirksam ist, könnten Adipositas und/oder T2DM auch an der Immunoseneszenz im Zusammenhang mit der Wirksamkeit von Impfstoffen gegen SARS-CoV-2 beteiligt sein. Bislang liegen nur wenige Studien über diesen Zusammenhang vor. In diesen Studien wurden bei geimpften Patienten mit schweren oder kritischen Erkrankungen unter den vorbestehenden Komorbiditäten häufig Übergewicht/Adipositas und T2DM festgestellt.
Da COVID-19 zu einer endemischen (regelmäßig auftretenden und sehr häufigen) Krankheit werden könnte, muss die Rolle von Fettleibigkeit und Stoffwechselstörungen bei der Förderung von SARS-Cov-2-Infektionen und der Schwere der Erkrankung sehr ernst genommen werden. Da Adipositas und Stoffwechselstörungen jedoch modifizierbare Risikofaktoren sind, besteht die Hoffnung, dass eine angemessene Prävention und Behandlung dieser Krankheiten ein wirksames Mittel zur Bekämpfung der COVID-19-Pandemie sein könnte.
Original-Publikation:
Stefan N.: Metabolic disorders, COVID-19 and vaccine-breakthrough infections. Nat Rev Endocrinol. 2021, https://doi.org/10.1038/s41574-021-00608-9
Neuer Zusammenhang zwischen Ernährung, Darmstammzellen und Krankheiten aufgedeckt
Diet-induced alteration of intestinal stem cell function underlies obesity and prediabetes in mice.
Nature Metabolism 2021
Adipositas, Diabetes und Magen-Darm-Krebs stehen oft mit einer ungesunden Ernährung in Verbindung. Welche molekularen Mechanismen dafür verantwortlich sind, ist nicht vollständig geklärt. Forschende des DZD und des Helmholtz Zentrums München haben neue Erkenntnisse gewonnen, die helfen, diesen Zusammenhang besser zu verstehen. Sie sind eine wichtige Basis für die Entwicklung nicht-invasiver Therapien.
Der Darm ist essentiell für die Aufrechterhaltung unseres Energiehaushaltes und ein Meister darin, schnell auf Veränderungen in der Ernährung und im Nährstoffhaushalt zu reagieren. Dies macht er mithilfe von Darmzellen, die unter anderem spezialisiert sind auf die Absorption der Nahrungsbestandteile oder die Sekretion von Hormonen. Beim erwachsenen Menschen bilden sich die Darmzellen alle fünf bis sieben Tage neu. Die Fähigkeit zur ständigen Erneuerung und zur Ausbildung jeglicher Darmzellarten aus Darmstammzellen ist entscheidend für die natürliche Anpassungsfähigkeit des Verdauungsorgans. Bei einer dauerhaften stark zucker- und fettreichen Ernährung ist jedoch diese Anpassung gestört und kann zur Entwicklung von Adipositas, Typ-2-Diabetes und Magen-Darm-Krebs beitragen.
Die molekularen Mechanismen hinter dieser Fehlanpassung gehören zum Forschungsgebiet von Heiko Lickert und seiner Gruppe am Helmholtz Zentrum München. Die Wissenschaftler:innen gehen davon aus, dass Darmstammzellen eine besondere Rolle bei der Fehlanpassung spielen. Mithilfe eines Mausmodells untersuchten die Forschenden die Auswirkungen einer zucker- und fettreiche Ernährung und verglichen sie mit einer Kontrollgruppe.
Von der hochkalorischen Diät zum erhöhten Risiko für Magen-Darm-Krebs
„Als erstes stellten wir fest, dass sich der Dünndarm bei der hochkalorischen Diät stark vergrößert, sagt Studienleiterin Anika Böttcher. „Gemeinsam mit den Experten für Computational Biology bei uns am Zentrum haben wir ein Profil von 27.000 Darmzellen von Mäusen erstellt. Mittels neuer Machine-Learning-Techniken fanden wir so heraus, dass sich Darmstammzellen bei den Mäusen mit ungesunder Diät deutlich schneller teilen und differenzieren.“ Die Forschenden gehen davon aus, dass dies auf eine Hochregulierung der entsprechenden Signalwege zurückzuführen ist, die bei vielen Krebsarten mit einer Beschleunigung des Tumorwachstums in Verbindung steht. „Dies könnte ein wichtiger Zusammenhang sein: Die Ernährung beeinflusst die Stoffwechselsignale, was zu einem übermäßigen Wachstum von Darmstammzellen und schließlich zu einem erhöhten Risiko für Magen-Darm-Krebs führt“, so Böttcher.
Mithilfe dieser hochauflösenden Technik konnten die Forschenden auch seltene Zellarten im Darm untersuchen, zum Beispiel hormonabsondernde Zellen. So konnten sie unter anderem zeigen, dass eine ungesunde Diät zu einer Verringerung der serotonin-produzierenden Zellen im Darm führt. Des Weiteren zeigte die Studie, dass sich die absorbierenden Zellen an die fettreiche Diät anpassen und ihre Funktionalität erhöhen und so direkt eine Gewichtszunahme begünstigen.
Wichtige Grundlagenforschung für nicht-invasive Therapien
Diese und weitere Erkenntnisse aus der Studie führen zu einem neuen Verständnis von Krankheitsmechanismen im Zusammenhang mit einer hochkalorischen Diät. „Was wir herausgefunden haben, ist von entscheidender Bedeutung, um alternative nicht-invasive Therapien zu entwickeln“, fasst Studienleiter Heiko Lickert die Ergebnisse zusammen. Dies könnte beispielsweise auf hormoneller Ebene geschehen durch gezielte Regulation des Serotoninspiegels. Diesen und weitere Ansätze wird die Forschungsgruppe in nachfolgenden Studien überprüfen.
Original-Publikation:
Aliluev et al., 2021: Diet-induced alteration of intestinal stem cell function underlies obesity and prediabetes in mice. Nature Metabolism, DOI: 10.1038/s42255-021-00458-9
Diabetes-Diagnose anhand von Ganzkörper-MRT
Diabetes detection from whole-body magnetic resonance imaging using deep learning.
JCI Insight 2021
Mit einer Ganzkörper-Kernspinaufnahme (MRT) lässt sich Typ-2-Diabetes diagnostizieren. Das zeigt eine aktuelle Studie von Forschenden des Deutschen Zentrums für Diabetesforschung, des Instituts für Diabetesforschung und Metabolische Erkrankungen des Helmholtz Zentrums München an der Universität Tübingen, des Max- Planck-Instituts für Intelligente Systeme und der Universitätsklinik Tübingen. Sie nutzten Deep-Learning-Methoden* und Daten von mehr als 2000 MRTs, um Patienten mit (Prä-)Diabetes identifizieren zu können. Die Ergebnisse wurden jetzt im Fachjournal JCI Insight veröffentlicht.
Übergewicht und viel Körperfett erhöhen das Risiko eines Diabetes. Doch nicht jeder übergewichtige Mensch erkrankt auch daran. Entscheidend ist, wo das Fett im Körper gespeichert wird. Lagert sich Fett unter der Haut an, ist es harmloser als Fett in tieferen Bereichen des Bauches (das sog. viszerale Fett). Wie das Fett im Körper verteilt ist, lässt sich mit Ganzkörper-Kernspintomographie gut darstellen. „Wir haben nun untersucht, ob man Typ-2-Diabetes auch anhand bestimmter Muster der Körperfettverteilung im MRT diagnostizieren könnte“, erläutert Letzt-Autor Prof. Robert Wagner den Ansatz der Forschenden.
Deep-Learning mit über 2.000 MRT-Aufnahmen trainiert
Um solche Muster zu erkennen, nutzten die Forschende künstliche Intelligenz (KI). Sie trainierten Deep-Learning-Netzwerke (Maschinelles Lernen) mit Ganzkörper-MRT-Aufnahmen von 2.000 Menschen, die sich auch einem Screening mit oralem Glukosetoleranz-Test (abgekürzt oGTT) unterzogen hatten. Mit dem oGTT, auch Zuckerbelastungstest genannt, lassen sich ein gestörter Glukosestoffwechsel nachweisen und ein Diabetes diagnostizieren. So lernte die KI, Diabetes zu detektieren.
Fettansammlung im Unterbauch wichtiger Hinweis auf Diabetesentstehung
„Eine Analyse der Modellergebnisse ergab, dass eine Fettansammlung im unteren Abdomen bei der Diabetesdetektion eine entscheidende Rolle spielt“, berichtet Wagner. Weitere zusätzliche Analysen zeigten zudem, dass auch ein Teil der Menschen mit einer Vorstufe des Diabetes (Prädiabetes) sowie Menschen mit einem Diabetes-Subtyp, der zu Nierenerkrankungen führen kann, über MRT-Aufnahmen identifiziert werden können.
Die Forschenden arbeiten nun daran, die biologische Steuerung der Körperfettverteilung zu entschlüsseln. Ein Ziel ist es, durch neue Methoden wie dem Einsatz von KI die Ursachen des Diabetes zu identifizieren, um bessere Vorsorge- und Therapiemöglichkeiten zu finden.
*Deep Learning, ist eine spezielle Methode aus dem Bereich des Maschinellen Lernens mit künstlichen neuronalen Netzen (KNN) und damit auch ein Teilgebiet der Künstlichen Intelligenz (KI). Deep Learning eignet sich besonders, wenn sehr viele unstrukturierte Daten vorliegen – wie z.B. Bilder und Aufnahmen. Um Deep-Learning-Algorithmen beizubringen, Bilder korrekt auszuwerten und Diagnosen vorherzusagen, werden sie an annotierten (mit Informationen versehenen) Daten trainiert.
Original-Publikation
Dietz et al.: Diabetes detection from whole-body magnetic resonance imaging using deep learning. JCI Insight, DOI: doi.org/10.1172/jci.insight.146999
Entwicklung eines neuen in vivo Modells für die Markierung sekretorischer Insulingranula Pools
Sequential in vivo labeling of insulin secretory granule pools in INS-SNAP transgenic pigs.
PNAS 2021
Die Funktionsstörung der Betazellen der Bauchspeicheldrüse ist eine der Hauptursachen für Typ-2-Diabetes (T2D). Jede Betazelle speichert Insulin in mehreren tausend Organellen, den insulinsekretorischen Granula (SG), die das Hormon freisetzen, wenn der Blutzuckerspiegel erhöht ist. Allerdings sind die diesem Prozess zugrunde liegenden Stimuli noch nicht vollständig geklärt. Viele Untersuchungen fanden zudem an isolierten Ex-vivo-Inselzellen in Nagetiermodellen statt. Um die bestehende translationale Lücke zum Menschen überwinden, haben Forschende u.a. aus dem Deutschen Zentrum für Diabetesforschung ein in vivo Modell (ein transgenes Schweinemodell) entwickelt, das die Untersuchung des Umsatzes der sekretorischen Insulingranula in vivo ermöglicht.
Die Betazellen der Bauchspeicheldrüse produzieren, speichern und sezernieren bei erhöhtem Blutzuckerspiegel das blutzuckersenkende Hormon Insulin. Bisher ist unser Verständnis der Prinzipien, die den Umsatz von insulinsekretorischen Granula steuern, noch sehr rudimentär. Hinzu kommt, dass das derzeitige Verständnis der Betazellfunktion größtenteils aus Studien an isolierten ex vivo Inseln in Nagetiermodellen stammt. Um diese bestehende translationale Lücke zum Menschen hin zu überwinden und den Umsatz der sekretorischen Insulingranula in vivo zu untersuchen, hat ein nationales Forschungsteam unter der Leitung von Forscherinnen und Forschern des DZD-Partners Paul-Langerhans-Institut des Helmholtz Zentrums München am Universitätsklinikum Carl Gustav Carus und der Medizinischen Fakultät der TU Dresden (PLID) und der LMU München ein transgenes Schweinemodell entwickelt, das erstmals die in vivo Fluoreszenzmarkierung von altersdifferenzierten Pools an sekretorischen Insulingranula ermöglicht und damit eine lebensnahe Darstellung des Insulinumsatzes unter normoglykämischen Bedingungen bietet.
Die Ergebnisse dieses in enger Zusammenarbeit durchgeführten Projekts wurden jetzt in der renommierten Fachzeitschrift "Proceedings of the National Academy of Sciences of the United States of America (PNAS)" veröffentlicht. Dieses neuartige, menschenähnliche Großtiermodell liefert wahrscheinlich Einblicke in den Umsatz von Insulingranula Pools unter physiologischen und pathologischen Bedingungen, welche dem von Typ-2-Diabetes beim Menschen ähneln.
Original-Publikation:
Kemter E., Müller, A., … Wolf, E., Solimena, M.: Sequential in vivo labeling of insulin secretory granule pools in INS-SNAP transgenic pigs. PNAS September 14, 2021 118 (37) e2107665118; https://doi.org/10.1073/pnas.2107665118
Bei Covid-19-Patienten infiziert das Virus auch Inselzellen der Bauchspeicheldrüse
Viral Infiltration of Pancreatic Islets in Patients with COVID-19.
Nature Communications 2021
Bei Menschen mit COVID-19 kann das Virus SARS-CoV-2 auch die Inselzellen der Pankreas befallen und sich dort vermehren. Das ist das Ergebnis einer aktuellen Studie, an der auch Forscherinnen und Forscher der DZD mitgearbeitet haben. Die Studie ist jetzt in Nature Communications erschienen.
Stoffwechselerkrankungen erhöhen das Risiko für schwere Verläufe einer COVID-19-Erkrankung. Umgekehrt werden bei COVID-19-Patienten u.a. auch neu auftretende Hyperglykämien (erhöhte Blutzucker-Werte), Entgleisungen des Stoffwechsels (Ketoazidosen), Diabetes und schwere metabolische Komplikationen eines vorbestehenden Diabetes beobachtet. Doch was ist die Ursache hierfür? Befällt das Virus auch die Insulin-produzierenden Betazellen? Erste Untersuchungen an Stammzellen deuteten darauf hin, dass das Virus SARS-CoV-2 menschliche Alpha- und die Insulin-produzierenden Betazellen der Bauchspeicheldrüse infiltrieren, infizieren und sich dort vermehren kann. Nun hat ein Team von Forscherinnen und Forschern Autopsie-Gewebe der Pankreas von COVID-19-Patienten analysiert. Auch hier stellte es eine virale SARS-CoV-2-Infiltration der Betazellen fest. Mithilfe von SARS-CoV-2-Pseudoviren wies das Team zudem nach, dass isolierte menschliche Inselzellen für eine Infektion empfindlich (permissiv) sind.
Bei elf COVID-19-Patienten untersuchte das Wissenschaftler-Team die Expression verschiedener Rezeptoren und Faktoren, die den Viruseintritt erleichtern können, darunter u.a. auch ACE2. Dabei zeigte sich, dass zwar 70 % der COVID-19-Patienten ACE2 im Blutkreislaufsystem exprimierten, aber nur 30 % wiesen eine ACE2-Expression in den Betazellen auf.
„Zusammenfassend lässt sich sagen, dass wir unter Verwendung von menschlichen Inselzellen und Autopsiegewebe von Patienten, die an COVID-19 gestorben sind, den eindeutigen Beweis erbracht haben, dass Betazellen für eine Infektion mit SARS-CoV-2 permissiv sind“, sagt Letzt-Autor Stefan Bornstein vom DZD-Paul Langerhans Institut Dresden des Helmholtz Zentrum München am Universitätsklinikum und der Medizinischen Fakultät Carl Gustav Carus der TU Dresden. „Die genauen Mechanismen des Viruseintritts sind zu diesem Zeitpunkt jedoch noch nicht vollständig geklärt, da ACE2 nur bei einer Untergruppe von Patienten in Betazellen exprimiert wird.“
Original-Publikation:
Steenblock et al.: Viral infiltration of pancreatic islets in patients with COVID-19. Nature Communications (2021) 12:3534, DOI: doi.org/10.1038/s41467-021-23886-3
Entwicklung neuer blutzuckersenkender Dextromethorphane, die nicht auf das Gehirn wirken
Peripherally Active Dextromethorphan Derivatives Lower Blood Glucose Levels by Targeting Pancreatic Islets.
Cell Chemical Biology 2021
Forscherinnen und Forscher haben den Wirkstoff Dextromethorphan (DXM) chemisch so verändert, dass er auf die Inselzellen im Pankreas wirkt und den Blutzuckerspiegel senkt, ohne das zentrale Nervensystem zu beeinflussen. Die aktuellen Ergebnisse sind jetzt in Cell Chemical Biology erschienen.
Der Wirkstoff Dextromethorphan (DXM) ist vor allem als Hustenstiller bekannt. Untersuchungen zeigen, dass DXM ebenso die Inselzellen der Bauchspeicheldrüse schützt und den Blutzucker senken kann. Allerdings wirkt das Medikament auch auf das Gehirn und kann Schwindel und Müdigkeit verursachen. Forscherinnen und Forschern des DZD-Partners Deutsches Diabetes-Zentrum (DDZ) ist nun gelungen, DXM chemisch so zu modifizieren, dass es nicht mehr die Bluthirnschranke passiert, trotzdem aber seine positiven Wirkungen voll entfaltet.
Das Forschungsteam konnte zeigen, dass die neuen DXM-Derivate Mäuse- und menschliche Pankreasinseln vor dem Zelltod schützen. Die Derivate senken zudem den Blutzuckerspiegel, ohne das Verhalten von Mäusen zu beeinflussen. Die Beobachtung, dass die neuen Wirkstoffe deutlich weniger Nebenwirkungen aufweisen, macht sie zu interessanten Kandidaten für eine künftige Diabetestherapie.
Die Ergebnisse können aber auch für weitere Anwendungen interessant sein: Der Wirkstoff Dextromethorphan ist chemisch mit Morphium verwandt. Diese Ergebnisse zeigen, wie man DXM und möglicherweise auch andere Morphine chemisch modifizieren kann, dass sie keine Nebenwirkungen auf das Gehirn haben und dennoch das periphere Gewebe erreichen.
Original-Publikation:
Scholz, O., Otter, S., Welters, A., Wörmeyer, L., Dolenšek, J., Klemen, S.M., Pohorec, V., Eberhard, D., Mrugala, J., Hamacher, A., Koch, A., Sanz, M., Hoffmann, T., Hogeback, J., Herebian, D., Klöcker, N., Piechot, A., Mayatepek, E., Lammert, E.: Peripherally active dextromethorphan derivatives lower blood glucose levels by targeting pancreatic islets. Cell Chemical Biology. 2021, 11 June, DOI: https://doi.org/10.1016/j.chembiol.2021.05.011
Neuer Mechanismus entdeckt: Wie höhere Leptin-Werte zu erhöhtem Blutdruck führen können
Obesity-Associated Hyperleptinemia Alters the Gliovascular Interface of the Hypothalamus to Promote Hypertension.
Nature Metabolism 2021
Forschende haben erstmal gezeigt, welche Rolle Astrozyten im Hypothalamus bei Adipositas-bedingtem Bluthochdruck spielen und wie das Hormon Leptin an der Verdichtung von Blutgefäßen im Hypothalamus adipöser Mäuse beteiligt ist. Die Studie ist in Nature Metabolism erschienen.
Pathologien des mikro- und makrovaskulären Systems sind ein Kennzeichen des metabolischen Syndroms, das zu chronisch erhöhtem Blutdruck führen kann. Bisher sind die zugrundeliegenden Pathomechanismen noch nicht geklärt. Forschende konnten nun erstmals zeigen, dass ein Adipositas-assoziierter Anstieg des Serum-Leptins zu einer Verdichtung von Blutgefäßen im Hypothalamus in präautonomen Gehirnzentren führen, die die hämodynamische Homöostase regulieren.
Erhöhten die Forschenden den Leptin-Spiegel, so kurbelten bestimmte Gehirnzellen, die Astrozyten, die Produktion eines spezifischen Wachstumsfaktors an. Dieser förderte wiederum das Wachstum der Gefäße. Das Ergebnis war eine erhöhte Anzahl der Gefäße im Hypothalamus (und keiner anderen Gehirnregion). Damit wiesen die Wissenschaftler und Wissenschaftlerinnen nach, dass Leptin für die Verdichtung der Gefäße im Hypothalamus hauptverantwortlich ist und dieser Prozess über die Astrozyten vermittelt wird.
Die Studie wurde vom Helmholtz Zentrum München angeleitet, Forschende der Ludwig-Maximilians-Universität, der Technischen Universität München und des Deutschen Diabetes Zentrums waren ebenfalls beteiligt.
Original-Publikation:
Gruber et al., 2021: Obesity-associated hyperleptinemia alters the gliovascular interface of the hypothalamus to promote hypertension. Nature Metabolism, DOI: 10.1016/j.cmet.2021.04.007
Highlight-Artikel in Nature Reviews Endocrinology: https://www.nature.com/articles/s41574-021-00511-3
Hohes Gewicht wirkt sich negativ auf den sozioökonomischen Status aus
The Effect of BMI and Type 2 Diabetes on Socioeconomic Status: A Two-Sample Multivariable Mendelian Randomization Study.
Diabetes Care 2021
Menschen mit einem hohen Body-Mass-Index (BMI) haben oft ein niedriges Einkommen und wohnen in Regionen mit einer höheren räumlichen Deprivation*. Forschende des Helmholtz Zentrums München und des Deutschen Zentrums für Diabetesforschung (DZD) konnten in einer Studie zeigen, dass es einen kausalen Zusammenhang zwischen einem hohem BMI und einem niedrigen sozioökonomischen Status gibt. Die Studie ist in Diabetes Care erschienen und wurde in Kooperation mit Forschenden der LMU (Munich School of Management and Munich Center of Health Sciences) und der TUM (Public Health und Prävention) durchgeführt.
Bereits frühere Untersuchungen deuteten darauf hin, dass Menschen mit starkem Übergewicht und Typ-2-Diabetes (T2D) auch schlechtere Chancen u.a. auf dem Arbeitsmarkt haben und über ein niedrigeres Einkommen verfügen. Wie sich ein hoher BMI und Typ-2-Diabetes kausal auf den sozioökonomischen Status auswirken, haben Forscherinnen und Forscher in der vorliegenden Studie nun durch ein spezielles Untersuchungsdesign (Mendelian Randomization) untersucht. Dabei wurde der genetische und somit von Umwelteinflüssen unabhängige Einfluss von BMI und Diabetes berücksichtigt.
Es zeigte sich, dass Menschen mit einem erhöhten BMI häufiger über ein niedriges Einkommen verfügen und in Gebieten mit einer höheren Deprivation wohnen. Gründe hierfür können in einer geringeren Arbeitsfähigkeit, höheren Fehlzeiten, einer höheren Wahrscheinlichkeit für Muskel-Skelett-Erkrankungen oder einer höheren sozialen Diskriminierung liegen. Diese Faktoren können wiederum zu schlechteren Berufsaussichten, abnehmender Arbeitsmarktbeteiligung und geringerem Einkommen führen, schlussfolgern die Autoren. Ein geringeres Einkommen könnte wiederum dazu führen, dass Betroffene in benachteiligte Gebiete mit günstigeren Wohn- und Lebensmittelangeboten ziehen.
Die Untersuchungen zeigten jedoch keinen negativen Einfluss von Typ-2-Diabetes auf den sozioökonomischen Status. Die Autoren regen weitere Untersuchungen an, um mithilfe neuer genomweiter Assoziationsstudien die Auswirkungen von Typ-2-Diabetes auf den sozioökonomischen Status genauer zu untersuchen. Zudem sollten die Mechanismen weiter untersucht werden, die zu einer Benachteiligung von Menschen mit erhöhtem BMI führen.
Original-Publikation:
Sara Pedron et al: The Effect of BMI and Type 2 Diabetes on Socioeconomic Status: A Two-Sample Multivariable Mendelian Randomization Study. Diabetes Care 2021 Mar; 44(3): 850-852. DOI: https://doi.org/10.2337/dc20-1721
* räumliche Deprivation
Räumliche Deprivation ist ein Maß für soziale Ungleichheit und beschreibt materielle Unterschiede zwischen Regionen oder Gebieten anhand von Größen wie der Arbeitslosenquote, des Besitzes eines Hauses oder Autos und der Wohnfläche pro Haushaltsmitglied.
Risiko für Typ-1-Diabetes sinkt nach den ersten Lebensjahren
An Age-Related Exponential Decline in the Risk of Multiple Islet Autoantibody Seroconversion During Childhood.
Diabetes Care, 2021
Das Risiko, die Autoimmunerkrankung Typ-1-Diabetes zu entwickeln, ist in den ersten Lebensjahren am höchsten und nimmt mit dem Alter exponentiell ab. Das ist das Ergebnisse einer aktuellen Auswertung der TEDDY-Studie, die jetzt in Diabetes Care erschienen ist. Die neuen Erkenntnisse können auch das Screening auf präsymptomatischen Typ-1-Diabetes verbessern.
Bereits Jahre vor der klinischen Manifestation der Autoimmunerkrankung Typ-1-Diabetes (T1D) sind im Blut der Betroffenen Antikörper (Insel-Autoantikörper) nachweisbar, die sich gegen die insulinproduzierenden Betazellen in den Inselzellen der Bauchspeicheldrüse oder gegen das Hormon Insulin richten. Die aktuelle Auswertung der TEDDY-Daten überprüfte, wie sich mit zunehmendem Alter das Risiko verändert, Typ-1-Diabetes zu entwickeln. Dazu analysierten die Forschenden 8.556 genetisch gefährdete Kinder prospektiv in 3- bis 6-monatigen Abständen ab der Geburt auf die Entwicklung von verschiedener Insel-Autoantikörpern und T1D.
Dabei zeigte sich, dass das 5-Jahres-Risiko, multiple Insel-Autoantikörper zu entwickeln, im Alter von 7,5 Monaten 4,3 Prozent betrug. Bereits ab einem Alter von etwas mehr als sechs Jahren sank es auf 1,1 Prozent. Die Autoren der Studie schlussfolgern daher, dass das Risiko, eine Inselautoimmunität zu entwickeln, mit dem Alter exponentiell abnimmt und dass der Einfluss der wichtigsten genetischen Faktoren auf die ersten Lebensjahre beschränkt ist.
Die neuen Erkenntnisse können auch helfen, das Screening auf präsymptomatischen Typ-1-Diabetes zu verbessern. Die Untersuchung zeigte, dass eine 2-fache Testung auf Insel-Autoantikörper - erstmalig im Alter von zwei Jahren und dann erneut im Alter von 5-7 Jahren - die höchste Sensitivität hatte und sich damit die meisten Kinder aufspüren ließen, die ein Frühstadium des Typ-1-Diabetes entwickelt hatten.
Nach Ansicht der Autorinnen und Autoren ist die große Anzahl an robusten Daten, die in der TEDDY-Studie erhoben wurden, eine Stärke der aktuellen Auswertung. Es gelte jedoch zu bedenken, dass alle TEDDY-Kinder eine bestimmte genetische Konstellation haben, die als Einschlusskriterium für die TEDDY-Studie festgelegt wurde. Daher entspricht die Studienpopulation nicht ganz der allgemeinen Bevölkerung.
Original-Publikation:
Bonifacio, E. et al.: An age-related exponential decline in the risk of multiple islet autoantibody seroconversion during childhood. DOI: https://doi.org/10.2337/dc20-2122
*Über die TEDDY-Studie
The Environmental Determinants of Diabetes in the Young, kurz TEDDY-Studie, ist ein internationales Forschungsprojekt (USA, Finnland, Deutschland und Schweden), welches die möglichen Risikofaktoren für die Entstehung von Typ-1-Diabetes untersucht. In die Studie wurden mehr als 8.600 Neugeborene mit einem erhöhten genetischen Risiko für T1D aufgenommen und bis ins Teenageralter engmaschig beobachtet. Die große Mehrheit der teilnehmenden Kinder (89 Prozent) hatte keine nahen Verwandten mit Typ-1-Diabetes.
https://teddy.epi.usf.edu
Das Langlebigkeitsgen mINDY (I’m Not Dead, Yet) verhindert nicht nur Stoffwechselerkrankungen, sondern senkt auch den arteriellen Blutdruck und die Herzfrequenz
The Longevity Gene mINDY (I’m Not Dead, Yet) Affects Blood Pressure Through Sympathoadrenal Mechanisms.
JCI Insight, 2021
Eine reduzierte Expression des Langlebigkeitsgens mammalian Indy (mINDY) verlängert in niederen Organismen die Lebensspanne und schützt Mäuse vor diätinduzierter Fettleibigkeit, Fettleber und Insulinresistenz. DZD-Forschende konnten nun erstmals zeigen, dass mINDY auch an der Blutdruckregulation beteiligt ist und eine reduzierte Expression den Blutdruck sowie die Herzfrequenz bei Nagetieren senkt. Die Studie ist jetzt im Journal of Clinical Investigation (JCI) insight erschienen.
Andreas Birkenfeld und Kollegen konnten zeigen, dass die Deletion von mIndy die sympathoadrenale Kontrolle des Blutdrucks moduliert und den arteriellen Blutdruck und die Herzfrequenz in einem muine-Knockout-Modell reduziert. Der Blutdruck wurde invasiv mit intra-arteriellen Drucksonden über mehrere Tage gemessen. Urinanalysen auf Katecholamine und Metanephrine sowie eine offene transkriptomische Analyse der Nebennieren identifizierten die betroffenen Biosynthesewege. Tatsächlich war die Katecholamin-Biosynthese in den mINDY-KO-Nebennieren abgeschwächt, während die Plasmasteroide und die Steroidhormonsynthese unbeeinflusst blieben.
In-vitro-Studien an einer Nebennieren-Zelllinie unterstützten diese Hypothese. mIndy kodiert für ein in der Plasmamembran exprimiertes Carbonsäure-Transporterprotein. Citrat, das Hauptsubstrat des mINDY-Transporters, erhöhte den Katecholamingehalt, während die pharmakologische Hemmung von mINDY durch einen ‚small molecule‘ Inhibitor diesen Effekt abschwächte.
Die Studie lieferte weitere Einblicke in die physiologischen Mechanismen der vorteilhaften Effekte einer Reduktion der mINDY-Aktivität, von der bekannt ist, dass sie durch ähnliche Mechanismen wie die des Fastens, vor ernährungs- und alterungsbedingten Stoffwechselkrankheiten schützt. Daher zeigten die Daten einen neuartigen Mechanismus, der zur kardiometabolischen Kommunikation beiträgt und mINDY als vielversprechendes Target für das gesamte Spektrum der Komponenten des metabolischen Syndroms, einschließlich des erhöhten Blutdrucks, weiter unterstützt.
Die Studie wurde vom Institut für Diabetesforschung und Metabolische Störungen (IDM) des Helmholtz-Zentrums München an der Universität Tübingen und der Klinik für Diabetes, Endokrinologie und Nephrologie des Universitätsklinikums Tübingen veröffentlicht.
Original-Publikation:
Willmes DM et al.: The longevity gene mIndy (I’m Not Dead, Yet) affects blood pressure through sympathoadrenal mechanisms. JCI Insight. 2021, https://doi.org/10.1172/jci.insight.136083.
Einsatz von Diabetestechnologien hängt auch vom sozioökonomischen Status ab
A Decade of Disparities in Diabetes Technology Use and HbA 1c in Pediatric Type 1 Diabetes: A Transatlantic Comparison.
Diabetes Care, 2020
Insulinpumpen, kontinuierliche Glukosemessgeräte (CGMs) – in den vergangenen zehn Jahren hat der Einsatz von Diabetestechnologien zum Management von Typ-1-Diabetes bei Kinder und Jugendlichen weltweit zugenommen. Forschende des DZD in Düsseldorf, München und Ulm haben gemeinsam mit Kollegen aus den USA untersucht, ob die Ungleichheit beim Zugang zu diesen Technologien aufgrund des sozioökonomischen Status (SES) auch zu unterschiedlich hohen Blutzuckerwerten (HbA1c) führt. Ihre Studie, die jetzt in ‚Diabetes Care‘ veröffentlicht wurde, zeigt „Ein Jahrzehnt der Ungleichheiten bei der Nutzung von Diabetestechnologien und HbA1c bei pädiatrischem Typ-1-Diabetes“.
Für die Studie haben die Forschenden den Einsatz von Diabetestechnologien sowie die HbA1c-Werte bei Kindern und Jugendlichen unter 18 Jahren aus den Registern „Type 1 Diabetes Exchange“ (T1DX, USA, n = 16.457) und „Diabetes-Patienten-Verlaufsdokumentation“ (DPV, Deutschland, n = 39.836) nach sozioökonomischem Status zwischen zwei Zeiträumen 2010-2012 und 2016-2018 untersucht. Dazu wurden die Register in Quintile (Fünftel) unterteilt. Zur Kategorisierung in Q1 (niedrigster SES) bis Q5 (höchster SES) wurden u.a. Versicherungsart, Bildungsgrad und Jahreseinkommen genutzt.
Dabei zeigte sich, dass Teilnehmer mit niedrigerem SES höhere HbA1c-Wert hatten (in den Jahren 2010-2012 und 2016-2018, jeweils: 8,0 % und 7,8 % in Q1 und 7,6 % und 7,5 % in Q5 für DPV; 9,0 % und 9,3 % in Q1 und 7,8 % und 8,0 % in Q5 für T1DX). Beim DPV-Register änderte sich der Zusammenhang zwischen SES und HbA1c zwischen den beiden Zeiträumen nicht. Bei den Probanden aus dem T1DX-Register nahmen die Unterschiede bei den HbA1c-Werten nach SES signifikant zu (P < 0,001). Nach Adjustierung für Technologieeinsatz änderten sich die Ergebnisse bei den Teilnehmern aus dem DPV-Register nicht, während der Anstieg bei den Probanden aus dem T1DX-Register nicht mehr signifikant war.
Obwohl keine kausalen Schlüsse gezogen werden können, ist im T1DX-Register bei Personen aus dem untersten SES-Quintil die Nutzung von Diabetestechnologie am niedrigsten und der HbA1c-Wert am höchsten. Die Unterschiede bei den HbA1c-Werten haben sich im vergangenen Jahrzehnt vergrößert. Im DPV-Register waren die Assoziationen von SES mit Technologieeinsatz und HbA1c schwächer.
Original-Publikation:
Addala et al.: A Decade of Disparities in Diabetes Technology Use and HbA 1c in Pediatric Type 1 Diabetes: A Transatlantic Comparison. Diabetes Care (2020); DOI: 10.2337/dc20-0257
Hochauflösende 3D-Mikroskopie ermöglicht die Rekonstruktion der Schnellstraßen des Insulintransports
Three-Dimensional Fib-Sem Reconstruction of Microtubule-Organelle Interaction in Whole Primary Mouse Beta Cells.
Journal of Cell Biology, 2020
Mikrotubuli sind ein Teil des Zytoskeletts und fungieren als Verbindungswege für den Transport von unterschiedlichen Arten von „Fracht“ innerhalb der Zelle. Ihre Rolle beim Insulintransport und der Insulinausschüttung wird jedoch derzeit diskutiert. Nun hat ein internationales Team angeführt von Wissenschaftlern des Paul-Langerhans-Instituts Dresden, einem Partner des Deutschen Zentrums für Diabetesforschung (DZD), zusammen mit dem CSBD, dem MPI-CBG, dem Janelia Research Campus, dem CMCB, dem Human Technopole und der EPFL mit Hilfe hochauflösender 3D-Elektronenmikroskopie die Insulin-sezernierenden pankreatischen Betazellen der Bauchspeicheldrüse in ihrer Gesamtheit mit einer bisher unerreichten Auflösung abgebildet. Dabei rekonstruierten die Wissenschaftler alle Insulingranula, Mikrotubuli, Mitochondrien, Golgi Apparate und Zentriolen, um eine umfassende räumliche Darstellung der Mikrotubuli-Organellen-Interaktionen erstellen zu können. Das Ergebnis dieses äußerst kooperativen Projekts wurde jetzt in der renommierten Zeitschrift "Journal of Cell Biology" veröffentlicht.
Links:
Segmentierungsmasken und Ausschnitte von analysierten Betazellen
Betazellvolumen in voller Auflösung zum Browsen
Original-Publikation:
Müller A, Schmidt D, Shan Xu C, Pang S, Verner D’Costa J, Kretschmar S, Münster C, Kurth T, Jug F, Weigert M, Hess HF, Solimena M., Three-dimensional Fib-Sem reconstruction of microtubule-organelle interaction in whole primary mouse beta cells. Journal of Cell Biology (2020), DOI: https://doi.org/10.1083/jcb.202010039
Fett in der Bauchspeicheldrüse kann Insulinausschüttung beeinträchtigen
Pancreatic Steatosis Associates With Impaired Insulin Secretion in Genetically Predisposed Individuals.
The Journal of Clinical Endocrinology & Metabolism, 2020
Bei Personen mit einem hohen genetischen Risiko für Typ-2-Diabetes kann eine verfettete Bauchspeicheldrüse (Pankreas-Steatose) zu einer Verschlechterung der körpereigenen Insulinproduktion führen. Darauf deuten Untersuchungen des DZD hin, die jetzt in The Journal of Clinical Endocrinology & Metabolism erschienen sind.
Es ist bekannt, dass mehr Fett im Körper das Risiko für Typ-2-Diabetes erhöht. Es ist dafür aber entscheidend, wo im Körper das Fett abgelagert wird. Vor allem die Ansammlungen von Bauchfett und Leberfett galten bisher als gefährlich für den Stoffwechsel. Die Bauchspeicheldrüse spielt eine zentrale Rolle in der Entstehung von Diabetes. Welche Bedeutung eine Verfettung des Pankreas für den Stoffwechsels hat, ist bisher wenig untersucht. Einige Studien deuten darauf hin, dass eine verfettete Bauchspeicheldrüse die Insulinausschüttung beeinträchtigt. Allerdings zeigt sich bei Menschen mit normalem Zuckerstoffwechsel kein negativer Zusammenhang zwischen Pankreas-Steatose und der Insulinsekretion. Forschende des DZD in Tübingen vermuteten, dass eine Pankreas-Steatose sich nur bei einer genetischen Veranlagung für Typ-2-Diabetes negativ auf die körpereigene Insulinproduktion auswirkt.
Um diese Hypothese zu überprüfen, untersuchten sie, wie die Wechselwirkung von genetischer Veranlagung und Fetteinlagerung in der Bauchspeicheldrüse die Insulinproduktion beeinflusst. Dazu werteten sie die Daten von 360 nicht-diabetischen Probanden der Tübinger Familienstudie (TUEF) mit einem erhöhten Risiko für Typ-2-Diabetes sowie die Daten von 64 Patienten aus, deren Bauchspeicheldrüse operativ entfernt werden musste. Mittels Magnetresonanztomographie (MRT) und mikroskopischer Untersuchung von Gewebeproben wurde der Fettgehalt der Bauchspeicheldrüse gemessen. Darüber hinaus wurde der genetische Risiko-Score für Typ-2-Diabetes bestimmt. Die Insulinsekretion haben die Forschenden mit dem oralen Glukosetoleranztest und der Nüchtern-Blutentnahme vor der Operation ermittelt.
Dabei zeigte sich eine schlechtere Insulinproduktion, wenn zu einem hohen genetischen Diabetes-Risiko auch eine Verfettung der Bauchspeicheldrüse bestand. Bei Personen mit niedrigem genetischen Risiko war das Pankreasfett nicht mit negativen Effekt vergesellschaftet. Die Forschenden vermuten, dass erst eine genetisch bedingte Insulinresistenz dazu führt, dass Pankreasfett für die Insulinsekretion schädlich wird.
Original-Publikation:
Róbert Wagner et al: Pancreatic Steatosis Associates With Impaired Insulin Secretion in Genetically Predisposed Individuals. The Journal of Clinical Endocrinology & Metabolism, Volume 105, Issue 11, November 2020, dgaa435, https://doi.org/10.1210/clinem/dgaa435
Zellatmung in Skelettmuskel und Fettgewebe reagiert unterschiedlich auf Ausdauertraining
Response of mitochondrial respiration in adipose tissue and muscle to 8 weeks of endurance exercise in obese subjects.
The Journal of Clinical Endocrinology & Metabolism, 2020
Bei adipösen Personen verbessert Ausdauertraining die Fitness und erhöht die Anzahl der Mitochondrien* sowie die Zellatmung in Skelettmuskeln. Die Intervention hat jedoch keinen Effekt auf die Zellatmung im Fettgewerbe. Das hat eine Studie von DZD-Forschenden ergeben, die jetzt in The Journal of Clinical Endocrinology & Metabolism veröffentlicht wurde.
Studien im Nager deuten darauf hin, dass Bewegung nicht nur die Anzahl der Mitochondrien und die Atmungskapazität der Skelettmuskulatur erhöht, sondern auch im Fettgewebe. In einer Studie untersuchten Forschende des DZD in Tübingen, welche Auswirkungen ein Ausdauertraining auf die Zellatmung in der menschlichen Skelettmuskulatur und im Fettgewebe des Bauchs hat und ob es einen direkten Zusammenhang zwischen der erhöhten Zellatmung und der verbesserten Insulinsensitivität gibt. Dazu führten die Forschenden mit 25 untrainierten Probanden (16 Frauen, 9 Männer im Alter von 29,8 ± 8,4 Jahre) mit Übergewicht oder Adipositas ein 8-wöchiges aerobes Ausdauertraining durch. Anschließend analysierten die Forschenden die mitochondriale Atmung in Skelettmuskelfasern und im Unterhautfettgewebe des Bauches.
Basierend auf der Veränderung der Insulinsensitivität nach der Intervention wurden die Probanden in Responder (Probanden, deren Insulinsensitivität sich erhöht hat) und Low-Responder (Probanden, deren Insulinsensitivität sich nicht signifikant erhöht hat) gruppiert. In beiden Gruppen verbesserte sich die Fitness, die Zellatmung und die Menge mitochondrialer Enzyme in den Skelettmuskeln gleichermaßen. Auf die Mitochondrien im abdominalen subkutanen Fettgewebe hatte das Ausdauertraining keine Wirkung. Ein interessanter weiterer Befund der Studie ist, dass Frauen eine höhere Zellatmung im Fettgewebe aufwiesen als Männer.
„Unsere Daten zeigen, dass die Erhöhung der mitochondrialen Atmungskapazität der Skelettmuskulatur nach einem Ausdauertraining keine Vorhersagekraft für die Verbesserung der peripheren Insulinsensitivität hat. Zudem bewirkt das Ausdauertraining keine Erhöhung der Zellatmung im subkutanen Fettgewebe, bei gleichzeitiger Abnahme dieses Fettkompartiments“, fasst Cora Weigert vom DZD-Partner Institut für Diabetesforschung und Metabolische Erkrankungen des Helmholtz Zentrum München an der Eberhard-Karls-Universität Tübingen die Ergebnisse zusammen.
* Mitochondrien sind die »Kraftwerke« der Zellen und spielen bei der der zellulären Energiegewinnung eine zentrale Rolle. In einem als Zellatmung bezeichneten Prozess werden Glucose und Fettsäuren mit Sauerstoff zu Kohlendioxid und Wasser umgewandelt, dabei entsteht Adenosintriphosphat (ATP), der Energieträger der Zellen.
Original-Publikation:
Hoffmann, C. et al.: Response of mitochondrial respiration in adipose tissue and muscle to 8 weeks of endurance exercise in obese subjects. The Journal of Clinical Endocrinology & Metabolism (2020) DOI: 10.1210/clinem/dgaa571
Proteinreiche Diät reduziert Leberfett
High-protein diet more effectively reduces hepaticfat than low-protein diet despite lower autophagy and FGF21 levels.
Liver International, 2020
Nicht-alkoholische Fettlebererkrankungen (NAFLD) sind insbesondere in Industrienationen weit verbreitet. Lebensstiländerungen mit ausgewogener Ernährung und vermehrter Bewegung sind nach wie vor die Therapie erster Wahl bei Fettlebererkrankungen. DZD-Forschende konnten zeigen, dass eine kalorienreduzierte Ernährung mit hohem Proteingehalt das Leberfett wirksamer reduzierte als eine kalorienreduzierte eiweißarme Ernährung. Die Ergebnisse wurden im Fachblatt ‚Liver International‘ veröffentlicht.
Die Forschenden untersuchten, wie der Eiweißgehalt der Nahrung die Menge des Leberfetts von stark übergewichtigen Menschen mit einer nicht-alkoholischen Fettleber beeinflusst. Dafür erhielten die 19 Probandinnen und Probanden für drei Wochen entweder eine Diät mit hohem (HP) oder niedrigem Proteingehalt (LP). Die intrahepatischen Lipidspiegel (IHL) und die Werte des Botenstoffs Fibroblast Growth Factor 21 (FGF21) wurden vor und nach der diätetischen Intervention gemessen. Anschließend wurden Operationen zur Behandlung des Übergewichts (bariatrische Chirurgie) durchgeführt und Leberproben entnommen. Zudem wurden Analysen zur Autophagie, der Histologie, der mitochondrialen Aktivität und der Genexpression durchgeführt.
Die Gruppe, die eine eiweißreiche Diät erhielt, nahm etwa fünf Kilogramm ab und der Fettgehalt in der Leber sank um 42,6 %. In der LP-Gruppe änderten sich die IHL-Werte trotz eines ähnlichen Gewichtsverlustes nicht signifikant. Gene, die in der Leber für die Aufnahme, Speicherung und Synthese von Fett verantwortlich sind, sind nach der eiweißreichen Ernährung weniger aktiv als nach der eiweißarmen Kost. Auch die Aktivität der Autophagie war im Lebergewebe nach der eiweißreichen Kost niedriger im Vergleich zur eiweißarmen. Die Aktivität der hepatischen Mitochondrien war in der HP-Gruppe nicht erhöht.
Die HP-Diät reduziert Leberfett trotz geringerer Autophagie wirksamer als die LP-Diät. Die Daten deuten darauf hin, dass die Leberfettreduktion bei einer HP-Diät in erster Linie aus der Unterdrückung der Fettaufnahme und Lipidbiosynthese resultiert.
Original-Publikation:
Xu, C., Markova, M., Seebeck, N., Loft, A., Hornemann, S., Gantert, T., Kabisch, S., Herz, K., Loske, J., Ost, M., Coleman, V., Klauschen, F., Rosenthal, A., Lange, V., Machann, J., Klaus, S., Grune, T., Herzig, S., Pivovarova-Ramich, O., Pfeiffer, A. F. H.: High-protein diet more effectively reduces hepaticfat than low-protein diet despite lower autophagy and FGF21 levels. Liver Inter. in press (E-pub ahead of print) (2020). [Open Access] [https://doi.org/10.1111/liv.14596]
Wie Insulin im Gehirn auf den Stoffwechsel und das Hungergefühl wirkt
Central nervous pathways of insulin action in the control of metabolism and food intake.
The Lancet Diabetes & Endocrinology, 2020
Das Gehirn ist ein insulinsensitives Organ. So reagiert eine Reihe von Gehirngebieten auf Insulin, etwa Areale, die für die Nahrungsaufnahme, den Stoffwechsel und das Gedächtnis wichtig sind. In einem Review-Artikel in The Lancet Diabetes & Endocrinology geben DZD-Forschende einen Überblick über aktuelle Studien, die die Wirkung von Insulin im Gehirn auf den Stoffwechsel und auf unser Essensverhalten untersuchen. Reagiert das Gehirn wenig oder gar nicht auf Insulin, könnte dies zu einem veränderten Essensverhalten und zu Stoffwechselerkrankungen führen.
Erkenntnisse aus der Humanforschung legen nahe, dass eine hohe Insulinsensitivität im Gehirn die Insulinsensitivität des ganzen Körpers erhöht und die Glukoseproduktion unterdrückt. Darüber hinaus dämpft Insulin im Gehirn die Nahrungsaufnahme. So werden Essensreize reduziert und die kognitive Kontrolle erhöht.
Untersuchungen bei Tier und Mensch zeigen zudem, dass Belohnungssysteme im Gehirn fein auf Insulin reagieren und hauptsächlich über das Dopaminsystem gesteuert werden. Diese Mechanismen sind bei Menschen mit Adipositas gestört, was ihr Risiko erhöhen könnte, an Typ-2-Diabetes und damit verbundenen Krankheiten zu erkranken.
Insgesamt heben die aktuellen Erkenntnisse die Rolle der Insulinwirkung im Gehirn und ihre Folgen für den peripheren Stoffwechsel und die Wahrnehmungsprozesse hervor.
Original-Publikation:
Kullmann et al: Central nervous pathways of insulin action in the control of metabolism and food intake. The Lancet Diabetes & Endocrinology (2020), DOI: https://doi.org/10.1016/S2213-8587(20)30113-3
Zusätzliche genetische Ursache für NAFLD entdeckt
Immunity-related GTPase induces lipophagy to prevent excess hepatic lipid accumulation.
Journal of Hepatology, 2020
Die Ursache der nicht-alkoholische Fettleberkrankheit (NAFLD) ist multifaktoriell bedingt, einschließlich genetischer und Umweltfaktoren. Gegenwärtig erklären nur wenige genetische Varianten die Erblichkeit der Erkrankung. DZD-Forschende haben jetzt neue Gene entdeckt, die bei der Entstehung der Fettleber eine Rolle spielen. Die Ergebnisse wurden im Journal of Hepatology veröffentlicht.
Die nicht-alkoholische Fettleberkrankheit (NAFLD) ist die Hauptursache für chronische Lebererkrankungen in Europa und den Vereinigten Staaten. Neben einer ungesunden Lebensweise mit fett- und zuckerreicher Ernährung und Bewegungsmangel ist auch eine genetische Veranlagung für die Entstehung dieser Lebererkrankung verantwortlich.
Mit Hilfe molekularer Marker und statistischer Methoden – quantitative trait locus (QTL)-Analyse – können Gene, die komplexe menschliche Krankheiten verursachen, in Mausstämmen identifiziert werden. Forscher haben jetzt eine neue Familie von Genen entdeckt, die eine wichtige Rolle bei der Verhinderung der Fettleberentwicklung spielen. Bei Menschen und Mäusen produzieren die Gene IRGM, Ifgga2 und Ifgga4 regulatorische Proteine aus der Familie der immunitätsbezogenen GTPasen, die der Fettansammlung in der Leber entgegenwirken. Kommt es jedoch zu einer genetischen Veränderung, werden weniger Proteine gebildet. Studien zeigen, dass die Leber von Patienten mit NAFLD und Mäusen mit Fettleber signifikant geringere Mengen dieser Proteine aufweist.
Funktionelle Studien haben gezeigt, dass eine Überproduktion von immunitätsbedingten GTPasen in Leberzellen oder in der Leber von Mäusen deren Fettgehalt signifikant reduziert. Der Grund dafür ist die Induktion einer bestimmten Form der Autophagie, die spezifisch für den Abbau von Fetten ist und daher als Lipophagie bezeichnet wird.
"Unsere Arbeit hat weitere wichtige Gene identifiziert, die Fettleberkrankheiten verursachen. Die Studienergebnisse vertiefen auch unser Verständnis dafür, welche zellulären Prozesse stimuliert werden müssen, um der Fettleberentwicklung entgegenzuwirken", sagte Professor Annette Schürmann, Leiterin der Abteilung Experimentelle Diabetologie am Deutschen Institut für Ernährungsforschung Potsdam-Rehbrücke (DIfE) und Sprecherin des Deutschen Zentrums für Diabetesforschung (DZD).
Original-Publikation:
Schwerbel, K. et al: Immunity-related GTPase induces lipophagy to prevent excess hepatic lipid accumulation. Journal of Hepatology (2020); DOI: https://doi.org/10.1016/j.jhep.2020.04.031
Fehlfunktion von Betazellen ist ein Hauptmerkmal der frühen Typ-2-Diabetes-Pathenogenese
Dysfunction of Persisting β-Cells is a Key Feature of Early Type 2 Diabetes Pathogenesis.
Cell Reports, 2020
Bereits in einer frühen Phase der Typ-2-Diabetes-Pathogenese verschlechtert sich die Funktion der Insulin-produzierenden Betazellen. Die Anzahl der Betazellen ist in diesem Stadium unverändert. Das ist das Ergebnis einer Studie, die jetzt von Wissenschaftlern des Deutschen Zentrums für Diabetesforschung in „Cell Reports“ veröffentlicht wurde.
Typ-2-Diabetes ist nicht nur durch Insulinresistenz gekennzeichnet, sondern auch dadurch, dass die Bauchspeicheldrüse weniger Insulin bildet. Bislang war jedoch unklar, ob der unzureichende Insulinspiegel während der Entwicklung der Erkrankung auf eine Fehlfunktion der Betazellen oder auf den Verlust der Betazellmasse zurückzuführen ist. Um hier neue Erkenntnisse zu gewinnen, haben Forschende unter der Leitung von Prof. Stephan Speier eine neuartige in situ-Plattform zur Untersuchung der menschlichen Bauchspeicheldrüse bei der Diabetes-Pathogenese genutzt. An der Studie waren Forscher des DZD, des Paul-Langerhans-Instituts Dresden des Helmholtz Zentrums München und der Medizinischen Fakultät Carl Gustav Carus der TU Dresden, des Universitätsklinikums Dresden und des King's College London beteiligt.
Die Gruppe nutzte für ihre Untersuchungen frisch entnommenes Pankreasgewebe, um die Funktion der Betazellen in ihrer ursprünglichen Organumgebung zu analysieren und das Betazellvolumen zu ermitteln. Die in dieser Studie untersuchten Gewebe stammten von Spendern einer größeren Patientenkohorte, die vor der Pankreatektomie metabolisch phänotypisiert worden waren. Die Gruppe umfasste dabei Menschen ohne Diabetes (ND), Personen mit eingeschränkter Glukosetoleranz (IGT) sowie Menschen mit Typ-2-Diabetes und repräsentierte damit das gesamte Entwicklungsspektrum der T2D-Pathogenese. „Nach der Herstellung von 120µm dicken Gewebeschnitten konnten wir die glukoseinduzierte Insulinsekretion unter nahezu physiologischen Bedingungen in Gewebe von Probanden quantifizieren und parallel an benachbarten Schnitten die 3D-Zellmorphologie untersuchen", erklärt der Erstautor Dr. Christian Cohrs vom PLID und dem DZD. Mit diesem neuen in situ-Ansatz für menschliche Pankreasgewebsschnitte war es erstmalig möglich, gleichzeitig die Betazellmasse und -funktion zu untersuchen und diese mit dem Diabetesstatus der Patienten zu korrelieren.
"Unsere Daten zeigen, dass die Betazellen bereits in frühen Stadien der T2D-Pathogenese, in denen die Probanden eine beeinträchtigte Glukosetoleranz aufweisen, aber noch nicht diabetisch sind, eine signifikante funktionelle Verschlechterung und Erschöpfung aufweisen. Demgegenüber bleibt die Anzahl der Betazellen des untersuchten Gewebes in diesem Stadium des Krankheitsverlaufs unverändert", fasst Prof. Speier, Gruppenleiter am Paul-Langerhans-Institut Dresden (PLID) und Professor am Institut für Physiologie der TU Dresden zusammen. "Unsere Ergebnisse legen somit eine Funktionsstörung der Betazellen als ein erstes Merkmal der Diabetes-Entwicklung nahe."
Original-Publikation:
Cohrs CM, Panzer JK, Drotar DM, Enos SJ, Kipke N, Chen C, Bozsak R, Schöniger E, Ehehalt F, Distler M, Brennand A, Bornstein SR, Weitz J, Solimena M, and Speier S. Dysfunction of Persisting β-Cells is a Key Feature of Early Type 2 Diabetes Pathogenesis. DOI:https://doi.org/10.1016/j.celrep.2020.03.033
Betazellfunktion im Tiermodell wiederhergestellt
Targeted pharmacological therapy restores β-cell function for diabetes remission.
Nature Metabolism, 2020
Eine der Ursachen von Diabetes könnte in der Dedifferenzierung von insulinproduzierenden Betazellen in den Langerhans´schen Inseln des Pankreas liegen, also dem Verlust der Zellidentität. In einer Studie am Mausmodell konnten DZD-Forschende am Helmholtz Zentrum München erstmals durch eine neue Kombinationstherapie eine Redifferenzierung herbeiführen und die Funktion der Betazellen wiederherstellen. Dies eröffnet neue Wege für eine mögliche Diabetes-Remission. Die Ergebnisse wurden in Nature Metabolism veröffentlicht.
Für ihre Studie arbeiteten die Forschenden an Mäusen mit Streptozotocin*-induziertem Diabetes. Mit Hilfe der Einzelzell-RNA-Sequenzierung konnten die Wissenschaftlerinnen und Wissenschaftler zeigen, dass die überlebenden Betazellen nach der Streptozotocin-Behandlung dedifferenzieren. Anhand des Modells prüften die Forschenden verschiedene Wirkstoffe darauf, ob sie die Funktion der dedifferenzierten Betazellen wiederherstellen konnten oder nicht. Das Ergebnis: Ein stabiles Konjugat aus dem Glucagon-ähnlichem Peptid-1 (GLP-1) und Östrogen (bereitgestellt von Novo Nordisk) ermöglichte eine gezielte und selektive Abgabe des Hormons in die Betazellen. Dabei erzielte die Kombination von GLP-1/Östrogen und einem langwirkenden Insulin besser Erfolge als eine Behandlung mit den einzelnen Wirkstoffen. Dies zeigte sich sowohl in der Normalisierung der Glykämie und Glukosetoleranz als auch in der Erhöhung des Insulingehalts der Bauchspeicheldrüse und der Anzahl der Betazellen.
Diese Studie beschreibt nicht nur die Mechanismen der Betazell-Dedifferenzierung und -Regeneration, sondern zeigt auch pharmakologische Ansatzpunkte auf, um dedifferenzierte Betazellen für eine Remission des Diabetes zu erreichen.
In der Studie arbeiteten Wissenschaftlerinnen und Wissenschaftler des Helmholtz Zentrums München (Helmholtz Diabetes Center und Institut für Computational Biology), des Deutschen Zentrums für Diabetesforschung (DZD), der TUM sowie der InSphero AG und Novo Nordisk zusammen, um den möglichen therapeutischen Nutzen einer GLP1/Östrogen-Behandlung im Tiermodell und an menschlichen Zellen in vitro zu untersuchen.
* Streptozotocin ist eine chemische Verbindung, die spezifisch toxisch auf insulinproduzierenden Betazellen wirkt.
Original-Publikation:
Sachs, S. et al, 2020: Targeted pharmacological therapy restores β-cell function for diabetes remission. Nature Metabolism, DOI: 10.1038/s42255-020-0171-3.
Zilien und Diabetes: Kleiner Zellfortsatz mit großer Wirkung
Glucose homeostasis is regulated by pancreatic β-cell cilia via endosomal EphA-processing.
Nature Communications, 2019
Funktionieren die Zilien an Betazellen der Bauchspeicheldrüse nicht richtig, kommt es zu Glukoseintoleranz und Typ-2-Diabetes. In ‚Nature Communications‘ beschreibt ein Forschungsteam des Helmholtz Zentrums München und des Deutschen Zentrums für Diabetesforschung (DZD) den zugrundeliegenden Mechanismus.
Die Insulin-produzierenden Betazellen haben primäre Zilien, die an der Regulierung des Glukosestoffwechsels, der Insulinsignalübertragung und -sekretion beteiligt sind. Um besser zu verstehen, wie diese wimpernähnlichen Zellfortsätze den Umgang mit Glukose beeinflussen, haben die Forschenden die Zilien von reifen Betazellen entfernt. Im Laufe von zwölf Wochen danach stellten sie fest, dass sich die Insulin-Freisetzung sowie die Glukose-Toleranz massiv verschlechterten.
Diese Phänomene wurden von speziellen Bindungsstellen auf Betazellen, den Ephrinrezeptoren, vermittelt. Dabei werden EphA/Ephrin Signale hochreguliert, die die Insulinsezernierung unterdrücken. Ähnliche Beobachtungen machten die Forschenden mit Inselzellen von Organspendern. Die Forschungsgruppe wertete außerdem Daten einer kleinen Kohorte von 19 Patientinnen und Patienten aus und fand dabei Korrelationen zwischen Ziliopathie*-Genen und dem Blutzuckerspiegel.
„Wir konnten in einem Mausmodell zeigen, dass Zilien in der Bauchspeicheldrüse direkte Wege der Zell-Zell-Kommunikation regulieren und so den Blutzuckerspiegel kontrollieren“, erläutert Dr. Jantje M. Gerdes. Die Ergebnisse der Untersuchungen könnten eine Grundlage für zukünftige Therapien – sowohl für Ziliopathien als auch Diabetes – bilden.
* Ziliopathien sind genetisch bedingte Erkrankungen von Zellen mit Zilien.
Original-Publikation:
F. Volta et al., 2019: Glucose homeostasis is regulated by pancreatic β-cell cilia via endosomal EphA-processing. Nature Communications, doi: 10.1038/s41467-019-12953-5
Typ-1-Diabetes: Defekter Schutz vor Angriff auf körpereigene Zellen
miRNA142-3p targets Tet2 and impairs Treg differentiation and stability in models of type 1 diabetes.
Nature Communications, 2019
Regulatorische T-Zellen (Tregs) verhindern bei gesunden Menschen überschießende Immunreaktionen. Bei der Entstehung der Autoimmunerkrankung Typ-1-Diabetes greift dieser Schutz nicht hinreichend. DZD-Forschende haben einen Mechanismus entschlüsselt, der die Bildung und die Stabilität von Tregs beeinträchtigt. Die Ergebnisse wurden in ‚Nature Communications‘ publiziert.
Das Team von Prof. Dr. Carolin Daniel konnte einen Mechanismus entschlüsseln, der in einem Frühstadium des Typ-1-Diabetes dazu führt, dass weniger funktionsfähige Tregs gebildet werden. Eine entscheidende Rolle spielt dabei die microRNA miRNA142-3p. MicroRNAs können das Ablesen einzelner Gene unterdrücken. „Während der Entstehung der Autoimmunität bei Typ-1-Diabetes konnten wir ein erhöhtes Level von miRNA142-3p feststellen. Das hat eine verminderte Expression des Proteins Tet2 in T-Helferzellen zur Folge “, erläutert Daniel. Dies führt zu fehlerhaften epigenetischen Veränderungen im Foxp3 Gen der regulatorischen T-Zellen. Es werden weniger dieser wichtigen Immunzellen gebildet und die Tregs sind nicht mehr so stabil.
Neuer Ansatzpunkt für zukünftige Interventionsstrategien
Um zu untersuchen, ob die Erkenntnisse künftig auch neue Therapieansätze eröffnen können, haben die Wissenschaftlerinnen und Wissenschaftler gezielt das Molekül miRNA142-3p unterdrückt. Dadurch verbesserte sich die Bildung und Stabilität der regulatorischen T-Zellen. Im Tiermodell ging zudem die Autoimmunreaktion gegen die Insulin-produzierenden Betazellen zurück.
An den Studien waren Forschende am Institut für Diabetesforschung (IDF) des Helmholtz Zentrums München, Deutschen Zentrums für Diabetesforschung (DZD) und der Ludwig-Maximilians-Universität München beteiligt.
Original-Publikation:
Scherm, M. G. et al. (2019): miRNA142-3p targets Tet2 and impairs Treg differentiation and stability in models of type 1 diabetes. Nature Communications, DOI: 10.1038/s41467-019-13587-3
Oral verfügbarer GLP-1 Agonist erstmals wirksamer als DPP-IV Inhibitor
Unter Beteiligung von Forschern des Paul Langerhans Institut Dresden (PLID) konnte erstmals ein GLP-1 Rezeptoragonist in Tablettenform mit der geläufigsten Second-Line Therapie des T2D, einem DPP-IV Inhibitor, verglichen werden. Die Untersuchungen dazu fanden im Rahmen der internationalen, randomisierten Doppelblindstudie PIONEER-3 parallel in Japan, Frankreich, England, Mexiko, Dänemark, den USA und Deutschland statt. Die Ergebnisse gelten als richtungweisend für die künftige Therapie des Typ-2-Diabetes.
Noch immer sterben Patienten mit Diabetes 2-3mal häufiger an kardiovaskulären Erkrankungen als Menschen ohne Diabetes. Vor diesem Hintergrund wurden in den letzten Jahren sogenannte Inkretin-Analoga, also Medikamente, die wie das Darmhormon GLP-1 zur Insulinausschüttung in den Betazellen der Bauchspeicheldrüse führen und gleichzeitig das Hungergefühl im Gehirn reduzieren, entwickelt. „Leider müssen diese Medikamente bislang, wie alle Peptid-basierten Medikationen aufgrund ihrer chemischen Struktur, per subkutaner Injektion verabreicht werden und können nicht oral als Tablette eingenommen werden“, so Prof. Dr. Andreas Birkenfeld, PLID, Mitautor der Studie. „Glücklicherweise ist es nun aber erstmals gelungen den GLP-1 Rezeptoragonisten (GLP-1RA) Semaglutid, durch eine Kombination mit einem Absorptionsverstärker, als Tablette verfügbar zu machen.“
In der 78-wöchigen PIONEER-3 Studie wurden 1864 Erwachsene mit diagnostiziertem Typ-2-Diabetes verglichen, welche entweder Metformin (mit oder ohne Sulfonylharnstoff), orales Semaglutid in drei verschiedenen Dosierungen oder Sitagliptin (100 mg/d) einnahmen. Dabei zeigte sich, dass orales Semaglutid dem Sitagliptin (jeweils in der höchsten Dosis) hinsichtlich der Blutzuckersenkung sowie der Reduktion des Körpergewichts überlegen war. Häufigste Nebenwirkungen der GLP-1RA waren gastrointestinale Effekte, wie Übelkeit. Diese waren zwar häufiger mit Semaglutid als mit Sitagliptin, jedoch sind diese bereits von anderen GLP-1RA bekannt und in vielen Fällen vorübergehend, so dass GLP-1RA als sicher eingestuft werden.
Original-Publikation:
Rosenstock J, Allison D, Birkenfeld AL, Blicher TM, Deenadayalan S, Jacobsen JB, Serusclat P, Violante R, Watada H, Davies M; PIONEER 3 Investigators. Effect of Additional Oral Semaglutide vs Sitagliptin on Glycated Hemoglobin in Adults With Type 2 Diabetes Uncontrolled With Metformin Alone or With Sulfonylurea: The PIONEER 3 Randomized Clinical Trial. JAMA. 2019 Mar 23. doi: 10.1001/jama.2019.2942. [Epub ahead of print]
Link zur Fach-Publikation:
https://jamanetwork.com/journals/jama/fullarticle/2729339
Gut eingestellter Blutzucker senkt Risiko für Herz-Kreislauf-Erkrankungen
Die Regulierung des Blutzuckers sollte Bestandteil kardiovaskulärer Präventions- und Gesundheitsförderungsmaßnahmen sein und in evidenzbasierte Leitlinien einfließen. Zu diesem Ergebnis kommt eine umfangreiche systematische Übersichtsarbeit (Umbrella Review) unter Federführung von DZD-Forschern am Paul Langerhans Institut Dresden (PLID), der im Journal of the American College of Cardiology (JACC) veröffentlicht wurde.
Ein zu hoher Blutzucker (Hyperglykämie) wie er bei Typ-2-Diabetes auftritt gilt als einer der zentralen Risikofaktoren für die Entwicklung kardiovaskulärer Erkrankungen. Doch wie wirkt sich ein über Medikamente oder Lebensstiländerungen gut eingestellter Blutzuckerspiegel auf das Herz-Kreislaufsystem aus? Kann das helfen, Erkrankungen des Herz-Kreislaufs-Systems wie zum Beispiel Herzinfarkte oder Schlaganfälle zu vermeiden? Um diese Fragen zu beantworten, werteten Forscherinnen und Forscher in einer systematischen Übersichtsarbeit aktuelle Untersuchungen zu präventiven Ansätzen auf dem Gebiet des Diabetes und der kardiovaskulären Erkrankungen aus. Die Analyse basierte auf drei getrennten systematischen Literaturrecherchen mit insgesamt 2.343 Reviews und Metaanalysen.
Menschen mit Typ-2-Diabetes haben ein zwei- bis dreifach höheres Risiko Herz-Kreislauferkrankungen zu bekommen. Die aktuelle Untersuchung zeigt, dass ein durch Medikamente gut eingestellter Blutzucker bei Menschen mit Typ-2-Diabetes das Risiko für Herz-Kreislauferkrankungen reduzieren kann. Die Analyse zeigt darüber hinaus, dass auch individuelle Lebensstilinterventionen wie gesunde Ernährung und Bewegung helfen können, den Blutzucker und somit indirekt auch das Risiko für Herz-Kreiserkrankungen effektiv zu senken.
Bevölkerungsweite Strategien reduzieren das Risiko sowohl direkt als auch indirekt: So hilft körperliche Aktivität am Arbeitsplatz, gefährliche kardiometabolische Ereignisse zu vermeiden. Zudem tragen Maßnahmen zur Reduzierung des Übergewichts bei Menschen mit Typ-2-Diabetes auch dazu bei, ein Hauptrisiko für Herz-Kreislauf-Erkrankungen zu senken.
„Unser Ergebnisse legen nahe, dass es sinnvoll ist, gemeinsame standardisierte Verfahren zu Diabetes-Prävention und -Management sowie zur Prävention von Herz-Kreislauf-Erkrankungen zu entwickeln“, sagt Erstautor Prof. Dr. Peter Schwarz vom Paul Langerhans Institut Dresden des Helmholtz Zentrums München am Universitätsklinikum Carl Gustav Carus der TU Dresden. Der DZD-Wissenschaftler und weitere Autoren des Papers schlagen vor, dass die Regulierung des Blutzuckers auch in evidenzbasierte Leitlinien einfließen sollte.
Original-Publikation:
Peter E.H. Schwarz et al. 2018: Blood Sugar Regulation for Cardiovascular Health Promotion and Disease Prevention, JACC Health Promotion Series, Journal of the American College of Cardiology 2018, https://doi.org/10.1016/j.jacc.2018.07.081
Eiweiß fördert Abklingen
Das körpereigenes Eiweiß DEL-1 sorgt als zentraler Akteur dafür, dass übermäßige Entzündungen abklingen. Die Bedeutung und die grundlegende Funktionsweise des Proteins konnte ein internationales Forscherteam mit Beteiligung von DZD-Wissenschaftlern zeigen.
Die Arbeit könnte neue Ansätze für die Behandlung von Krankheiten wie Multipler Sklerose, Stoffwechselerkrankungen, entzündlichen Knochenerkrankungen oder Krebs liefern. Die Ergebnisse der Untersuchung wurden im Fachjournal „Nature Immunology“ (www.nature.com, DOI /10.1038/s41590-018-0249-1) veröffentlicht.
Entzündungen sind eine natürliche Abwehrreaktion des Immunsystems gegen Krankheitserreger. Allerdings kann sich eine Entzündung sich ähnlich wie ein Feuer ausbreiten und lange andauern, wenn sie nicht wirkungsvoll bekämpft wird. Eine zentrale Rolle bei der körpereigenen Feuerwehr spielt das Protein DEL-1. „Wir konnten zeigen, dass DEL-1 die Immunabwehr entscheidend reguliert. Bildlich gesprochen steuert das Protein einen Großteil der Lösch- und Aufräumarbeiten. Das Verständnis dieses Mechanismus könnte künftig dazu beitragen, verschiedene entzündliche Erkrankungen besser zu behandeln“, sagt Prof. Triantafyllos Chavakis, Direktor des Instituts für Klinische Chemie und Laboratoriumsmedizin (IKL) der TU Dresden und Gruppenleiter am Paul Langerhans Institut Dresden.
Zu Beginn einer Entzündung wandern Neutrophile, in das betroffene Gewebe. Dort treiben sie Entzündung an ebenso wie Makrophagen. Das Protein DEL-1 bildet eine Art Brücke zwischen Makrophagen und absterbenden Neutrophilen. Dies veranlasst die Makrophagen zum einen dazu, absterbende Neutrophile in einer Art Aufräumaktion zu fressen. Zum anderen programmiert DEL-1 die Fresszellen dahingehend um, dass sie entzündungshemmende Stoffe produzieren. „Beides sind wichtige Prozesse, die die Entzündung zurückgehen lassen und ein gesundes Gleichgewicht im Gewebe wiederherstellen“, betonen Dr. Ioannis Kourtzelis und Dr. Ioannis Mitroulis, Wissenschaftler am IKL und am Nationalen Centrum für Tumorerkrankungen Dresden (NCT/UCC).
„Das Verständnis der Wirkungsweise von DEL-1 ist eine wichtige Grundlage, um neue Therapien gegen Stoffwechselerkrankungen zu entwickeln“, sagt DZD-Wissenschaftler Dr. Ünal Coskun vom Paul Langerhans Institut Dresden, welches zusammen vom Helmholtz Zentrum München mit dem Universitätsklinikum Carl Gustav Carus an der Technischen Universität in Dresden betrieben wird. Durch seine grundlegende Bedeutung für den Entzündungshaushalt ist DEL-1 für die Erforschung unterschiedlicher Erkrankungen interessant wie Multipler Sklerose, Stoffwechselerkrankungen, entzündlichen Knochenerkrankungen oder Krebs.
Original-Publikation:
Kourtzelis et al. DEL-1 promotes macrophage efferocytosis and clearance of inflammation. Nat Immunol. 2018 Nov 19. doi: 10.1038/s41590-018-0249-1. [Epub ahead of print]
Leptin-Resistenz verursacht Übergewicht
Viele übergewichtige Menschen vermissen das Gefühl, satt zu werden. Bisher nahm man an, das läge an einem gestörten Transport des Sättigungshormons Leptin ins Gehirn. Das ist so aber nicht richtig, wie eine Gruppe von DZD-Wissenschaftlern mithilfe eines neuen 3D-Bildgebungsverfahren zeigen konnte. Die Ursache scheint in den Nervenzellen zu liegen, wie die Forscher in einem Artikel in „International Journal of obesity“ beschreiben.
„In dicken Mäusen und Menschen wird Leptin in hoher Konzentration vom Fettgewebe in die Blutbahn freigesetzt, aktiviert aber nicht deren Sättigungszentren im Gehirn. Bislang ging man davon aus, dass die Ursache ihrer Hormonresistenz ein gestörter Transportprozess ist“, erklärt Luke Harrison, Doktorand am Helmholtz Zentrum München und Erstautor der Studie. Weil das Leptin nur noch eingeschränkt die Blut-Hirn-Schranke überwinden kann, so die Theorie, kommt weniger an in den Sättigungszentren. Mit einem neuartigen 3D-Verfahren konnten Forscher den Transport von Leptin erstmals sichtbar machen und untersuchen, diese Annahme widerlegen.
Mit dem neuen Bildgebungsverfahren hat das Forscherteam unter der Leitung von Dr. Paul Pfluger, Partner im Deutschen Zentrum für Diabetesforschung, nachgewiesen, dass Leptin sowohl in dünnen als auch in dicken Mäusen in ausreichender Menge in das Gehirn gelangt. Die Ursache für die Störung im Essverhalten muss also in den Nervenzellen selber liegen. „Wir können die Ursache von Leptin-Resistenz nun eingrenzen und unsere Forschung auf die molekularen Mechanismen innerhalb der Nervenzellen fokussieren“, erklärt Dr. Paul Pfluger.
Original-Publikation:
Luke Harrison et. al.: Fluorescent blood brain barrier tracing shows intact leptin transport in obese mice. International Journal of obesity. DOI:10.1038/s41366-018-0221-z
Atlas des zirkadianen Stoffwechsels
In einer umfangreich angelegten Studie wurde über 24 Stunden ein Stoffwechselprofil mehrerer Organe und Gewebe von Mäusen bei normaler und bei fettreicher Ernährung angefertigt: Heraus kam eine Übersicht, wie die verschiedenen Stoffwechselprozesse im Körper miteinander verzahnt sind und welche Zeitfenster sich für Therapien gegen Adipositas anbieten. Die Ergebnisse haben Forscherinnen und Forscher des DZD, des Helmholtz Zentrum München und der Universität von Kalifornien-Irvine jetzt in ‚Cell‘ veröffentlicht.
Die Wissenschaftler haben über 24 Stunden Stoffwechselprofile von acht verschiedenen Geweben gleichzeitig erstellt. Untersucht wurden der Nucleus suprachiasmaticus im Hypothalamus (gilt bei Säugetieren als Haupt-Taktgeber für die zirkadianen Rhythmen) sowie der präfrontale Cortex, Muskeln, Leber, braunes und weißes Fettgewebe, Blutserum und Sperma. Um zu verstehen, wie die Ernährung die zeitliche Koordination der Gewebe und den 24-Stunden-Stoffwechsel beeinflusst, haben die Forscher die Daten bei normaler und bei fettreicher Ernährung erhoben. Es ist bekannt, dass fettreiche Nahrung den 24-Stunden-Rhythmus stört und Stoffwechselkrankheiten verursacht. Die zeitliche Betrachtung des Gewebestoffwechsels in dieser Studie ermöglicht jetzt Einblicke, wie sich dieser etwa bei Adipositas und Diabetes verändert.
Die Ergebnisse: Zuviel Fett in der Nahrung bringt den Stoffwechsel durcheinander. Statt einer geordneten Abfolge der Energiegewinnung aus Fett und Zucker - wie bei einer normalen Ernährung - dominiert bei einer fettreichen Ernährung der Fettstoffwechsel. Diese Veränderung hat auch Auswirkungen auf die Insulinresistenz der Muskelzellen, die als Folge entstehen kann.
Die Arbeit bietet einen Überblick, wann welcher Stoffwechselprozess im jeweiligen Gewebe abläuft. Neben bisher unbekannten Zusammenhängen erschließen sich laut den Autoren dadurch auch Zeitfenster, wann stoffwechselwirksame Medikamente besonders erfolgsversprechend eingesetzt werden könnten.
Original-Publikation:
Dyar, KA. et al. (2018): Atlas of Circadian Metabolism Reveals System-wide Coordination and Communication between Clocks. Cell, DOI: 10.1016/j.cell.2018.08.042
Neue Biomarker als Risikofaktoren für Neuropathie identifiziert
Obwohl eine Polyneuropathie bei etwa 30% der Menschen mit Diabetes vorliegt, bleibt sie häufig undiagnostiziert. DZD-Wissenschaftler konnten nun erstmals zeigen, dass sechs Biomarker der Entzündung auf ein Risiko für eine Polyneuropathie hinweisen. Die Ergebnisse wurden in der aktuellen Ausgabe der Zeitschrift "Diabetes" veröffentlicht.
Viele Patienten mit Diabetes leiden auch an Polyneuropathie leiden. Dennoch weiß man derzeit relativ wenig über ihre Entstehung. Bislang ist bekannt, dass Entzündungsprozesse zu anderen diabetischen Komplikationen wie Herzinfarkt oder Schlaganfall beitragen. Ziel der Studie war daher die umfangreiche Analyse von Biomarkern, die Entzündungsprozesse als Risikofaktor für die distale sensorische Polyneuropathie charakterisieren. Dabei wurden sowohl Menschen mit Typ-2-Diabetes als auch Menschen in der älteren Allgemeinbevölkerung untersucht.
Studie – Ablauf und Design
Die Studie umfasste 513 Männer und Frauen der bevölkerungsbasierten KORA (Kooperative Gesundheitsforschung in der Region Augsburg) F4/FF4-Kohorte im Alter von 62 bis 81 Jahren, die zu Studienbeginn keine distale sensorische Polyneuropathie hatten. Von diesen Personen entwickelten während der 6,5-jährigen Nachbeobachtungszeit 127 Personen eine DSPN. Der Serumspiegel von insgesamt 71 Biomarkern der Entzündung wurde unter Verwendung der neuen Proximity-Extension-Assay-Technologie gemessen. Der Serumspiegel von 26 dieser 71 Biomarkern war bei Personen, die während der Studie eine Polyneuropathie entwickelten, höher als bei den Personen, die keine Polyneuropathie aufwiesen. Nach statistischer Korrektur für multiples Testen blieben höhere Konzentrationen von sechs Biomarkern mit dem DSPN-Risiko verbunden. Drei dieser Proteine (MCP-3/CCL7, MIG/CXCL9, IP-10/CXCL10) waren Chemokine, während die anderen drei (DNER, CD40, TNFRSF9) lösliche Formen von Transmembranrezeptoren waren.
„In unserer Studie haben wir neue Biomarker identifiziert, die das Risiko für die Entstehung einer Polyneuropathie anzeigen. Erstmals konnten wir auch Hinweise darauf finden, dass neben dem angeborenen Immunsystem das adaptive Immunsystem an der Entwicklung der Krankheit beteiligt sein könnte“, erläutert Prof. Dr. Christian Herder, Leiter der Studie am Deutschen Diabetes-Zentrum (DDZ), einem Partner des DZD.
Original-Publikation:
Herder C, Kannenberg J, Carstensen-Kirberg M, Strom A, Bönhof G, Rathmann W, Huth C, Koenig W, Heier M, Krumsiek J, Peters A, Meisinger C, Roden M, Thorand B, Ziegler D. A Systemic Inflammatory Signature Reflecting Crosstalk Between Innate and Adaptive Immunity Is Associated With Incident Polyneuropathy: KORA F4/FF4 Study. Diabetes. 2018 Aug 16. db180060. DOI: 10.2337/db18-0060 [Epub ahead of print]
Restriktive Lungenerkrankungen – späte Folge von Diabetes?
Eine Studie des Deutschen Zentrums für Diabetesforschung (DZD) und des Deutschen Zentrums für Lungenforschung (DZL) und des Universitätsklinikums Heidelberg deutet darauf hin, das Atemnot und restriktive Lungenerkrankungen (RLD) eine späte Komplikation von Typ-2-Diabetes sein könnten
Die Forscher untersuchten 110 Patienten mit langjährigem Typ-2-Diabetes, 29 Menschen mit neu diagnostiziertem Typ-2-Diabetes, 68 Patienten mit Prädiabetes und 48 Menschen ohne Diabetes auf Stoffwechselstörungen, diabetesbedingte Komplikationen, Atemnot und Lungenfunktion. Dabei zeigte sich, dass Menschen mit Typ-2-Diabetes signifikant häufiger an Atemnot und restriktiven Lungenerkrankungen leiden als die Kontrollgruppe. Die Prävalenz für RLD bei Patienten mit Diabetes lag zwischen 20 und 27 Prozent. Außerdem deuteten radiologische und histologische Analysen auf eine Assoziation mit fibrosierenden interstitiellen Lungenanomalien hin.
Darüber hinaus zeigte die Studie, dass RLD mit Albuminurie assoziiert ist. Bei der Erkrankung ist der Gehalt des Eiweißes Albumin im Urin erhöht. Dies kann ein Anzeichen sein, dass Lungenerkrankungen und Nierenerkrankungen (Nephropathie) miteinander assoziiert sein können.
Die Wissenschaftler vermuten daher, dass manche Lungenerkrankungen eine späte Folge von Typ-2-Diabetes sein können.
Original-Publikation:
Stefan Kopf, Jan B. Groener, Zoltan Kender, Thomas Fleming, Maik Brune, Christin Riedinger, Nadine Volk, Esther Herpel, Dominik Pesta, Julia Szendrödi, Mark O. Wielpütz, Hans-Ulrich Kauczor, Hugo A. Katus, Michael Kreuter, Peter P. Nawroth. Breathlessness and Restrictive Lung Disease: An Important Diabetes-Related Feature in Patients with Type 2 Diabetes. Respiration 2018, DOI: 10.1159/000488909
Neues Adipokin fördert Insulinresistenz
Bei starkem Übergewicht setzen Zellen des viszeralen Fetts ein Protein frei, das die Insulinresistenz und chronische Entzündungen fördert. Das hat ein internationales Team unter Leitung von Wissenschaftlern des Deutschen Zentrums für Diabetesforschung (DZD) herausgefunden.
Die Forschenden konnten zum ersten Mal zeigen, wie das Eiweißmolekül Wingless-type signaling pathway protein-1 (WISP1) direkt die Insulinwirkung in Muskelzellen sowie in der Leber negativ beeinträchtigt und dadurch zur Insulinunempfindlichkeit führt.
Die aktuelle Studie zeigt, dass WISP1 die Insulin-induzierte Hemmung von Glukoseproduktion (Glukoneogese) in murinen Leberzellen und die Erhöhung des Glykogenaufbaus (Glykogensynthese) in menschlichen Muskelzellen aufhebt. Die Synthesemenge des WISP1-Proteins korreliert mit den Blutzuckerkonzentrationen im Glukosebelastungstest (OGTT) sowie mit dem zirkulierenden Spiegel der Hämoxygenase-1 (HO-1), ein Enzym, das vor allem bei Adipositas chronische Entzündungen fördert.
Die Forscher vermuten, dass eine vermehrte WISP1-Produktion aus dem Bauchfett eine der Ursache sein könnte, warum übergewichtige Menschen oft einen gestörten Glukosestoffwechsel haben.
Original-Puplikation:
Hörbelt, T., Tacke, C., Markova, M. et al. (2018): The novel adipokine WISP1 associates with insulin resistance and impairs insulin action in myotubes and hepatocytes. Diabetologia. https://doi.org/10.1007/s00125-018-4636-9
Erhöhte Glucagon-Ausschüttung keine unabdingbare Voraussetzung für Diabetes
Nur bei einer Untergruppe des Typ-2-Diabetes (T2D) sind die Glucagon-Spiegel erhöht. Darauf deutet eine Studie von DZD-Forscherinnen und -Forschern aus München hin. Die Wissenschaftler untersuchten die Glucagon-Spiegel bei jungen Frauen mit unterschiedlich hohem Risiko für T2D während eines oralen Glukosetoleranztests*. Dabei entdeckten sie vier Muster der Glucagon-Dynamik, die nicht mit den metabolischen Phänotypen übereinstimmten. Die Ergebnisse wurden jetzt im ´J Clin Endocrinol Metab` veröffentlicht.
Glucagon ist der Haupt-Antagonist von Insulin. Doch welche Rolle das Hormon bei der Entstehung von Typ-2-Diabetes spielt, ist noch in der wissenschaftlichen Diskussion. Ein Forscher-Team verglich die Glucagon-Ausschüttungen bei jungen Frauen mit drei unterschiedlichen metabolischen Phänotypen während eines oralen Glukosetoleranztests. Die Gruppen waren: Eine gesunde Kontrollgruppe (93 Frauen), stoffwechselgesunde Frauen nach einem Schwangerschaftsdiabetes (Hochrisikogruppe, 121 Frauen) und 71 Frauen, bei denen bereits ein Diabetes beziehungsweise ein Prädiabetes neu diagnostiziert wurde.
In der Analyse zeigte sich, dass es vier Muster der Glucagon-Dynamik gibt. Allerdings stimmten die gefundenen Muster nicht mit den drei unterschiedlichen Stoffwechselgruppen überein. Zwar trat ein Muster – erhöhte Nüchtern-Glucagon-Werte mit einer verzögerten Glucagon-Unterdrückung – besonders häufig bei Frauen mit Diabetes und Prädiabetes auf (21 Prozent). Aber auch bei 8 Prozent der gesunden Frauen wurde dieses Cluster entdeckt. Umgekehrt wies die Mehrheit der Frauen aus der Gruppe Prädiabetes/Diabetes (n = 39; 55%) unauffällige Glucagon-Werte, mit einem niedrigem Nüchtern-Glucagon-Wert und einer schnellen Unterdrückung, auf. Abgesehen davon fanden sich in dem Cluster mit hohem Nüchtern-Glucagon und schlechter Glucagon-Unterdrückung vermehrte Anzeichen des Metabolischen Syndroms (hoher Blutdruck, viszerale Adipositas und hohe Blutlipide).
Die Studien-Autoren gehen daher davon aus, dass eine erhöhte Glucagon-Ausschüttung in einer Untergruppe zur Entwicklung eines Typ-2-Diabetes beitragen kann, dies jedoch keine unabdingbare Voraussetzung für die Diabetes-Entstehung ist.
Die Studie des DZD, des Klinikums der Universität München und des Helmholtz Zentrums München ist in der März-Ausgabe von `J Clin Endocrinol Metab´ erschienen.
Original-Publikation:
Gar, C. et al. (2018): Patterns of Plasma Glucagon Dynamics Do Not Match Metabolic Phenotypes in Young Women. J Clin Endocrinol Metab; DOI: 10.1210/jc.2017-02014
*Hintergrundinformation:
Oraler Glukosetoleranztest (oGTT)
Der oGTT liefert Hinweise auf die Fähigkeit des Körpers, eine definierte Menge an Glukose innerhalb eines bestimmten Zeitraumes abzubauen. Dazu werden 75 g Glukose als Zuckerlösung auf nüchternen Magen getrunken. Im Anschluss wird in bestimmten Abständen Blut entnommen und auf den Zuckergehalt hin untersucht.
Pumpentherapie für Kinder und Jugendliche besser als Insulinspritze
Association of Insulin Pump Therapy vs Insulin Injection Therapy With Severe Hypoglycemia, Ketoacidosis, and Glycemic Control Among Children, Adolescents, and Young Adults With Type 1 Diabetes.
JAMA, 2017
Die Behandlung mit einer Insulinpumpe bringt bei Kindern und Jugendlichen, die an Typ-1-Diabetes leiden, deutliche Vorteile gegenüber einer Spritzentherapie. Sie haben ein niedrigeres Risiko für schwerwiegende Stoffwechselentgleisungen (Ketoazidosen) und schwere Unterzuckerungen. Das belegt eine große Untersuchung an 350 Diabeteszentren in Deutschland, Österreich und Luxemburg, an der auch DZD-Wissenschaftler mitgearbeitet haben. Die Studie wurde im Fachmagazin „Journal of the American Medical Association“ veröffentlicht.
Typ-1-Diabetes ist die häufigste Stoffwechselerkrankung bei Kindern und Jugendlichen, in Deutschland sind schätzungsweise 31.000 junge Patienten davon betroffen. Die Mehrzahl wird mit einer Insulinpumpe behandelt. Allerdings existierten in der Fachwelt Befürchtungen, eine Pumpentherapie könnte vermehrt Ketoazidosen auslösen, die durch Insulinmangel entstehen. Auch lagen keine gesicherten Erkenntnisse vor, wie häufig schwere Unterzuckerungen („Hypoglykämien“) auftreten und ob die Patienten unerwünschter Weise an Gewicht zunehmen.
Antworten auf diese Fragen gibt nun die aktuelle Studie. Insgesamt verglichen die Forscherinnen und Forscher 9814 Patienten mit Insulinpumpe gegenüber 9814 Patienten mit einer Injektionstherapie. Der Zeitraum erstreckte sich von Januar 2011 bis Dezember 2015.
Die Ergebnisse der Studie: In der Gruppe mit Insulinpumpe war die Häufigkeit schwerer Hypoglykämien niedriger (9.55 versus 13.97 pro 100 Patienten und Jahr), ebenso die Häufigkeit von Unterzuckerungen mit Bewusstlosigkeit (2.30 versus 2.96 pro 100 Patienten und Jahr). Auch die Anzahl ketoazidotischer Entgleisungen lag in der Gruppe mit Pumpentherapie deutlich niedriger (3.64 versus 4.26 pro 100 Patienten und Jahr). Der mittlere HbA1c-Wert war mit 8.04 Prozent in der Pumpengruppe besser als in der Gruppe mit Insulin-Injektionen (8.22 Prozent). Pumpenpatienten benötigten zudem weniger Insulin pro Kilogramm Körpergewicht und Tag (0.84 versus 0.98 Einheiten), während sich der Body-Mass-Index-Wert zwischen beiden Gruppen nicht unterschied.
Original-Publikation:
Beate Karges et al: Association of Insulin Pump Therapy vs Insulin Injection Therapy With Severe Hypoglycemia, Ketoacidosis, and Glycemic Control Among Children, Adolescents, and Young Adults With Type 1 Diabetes. JAMA 2017; DOI:10.1001/jama.2017.13994
Verstärkt gebildetes DPP4 kann zu Leberverfettung führen
Elevated hepatic DPP4 activity promotes insulin resistance and non-alcoholic fatty liver disease. Molecular Metabolism, 2017
Wenn die Leber das Enzym DPP* verstärkt bildet und ins Blut abgibt, führt dies bei Mäusen unter einer fettreichen Ernährung zu einer stärkeren Körperfettzunahme, zur Leberverfettung sowie zu einer Insulin-Unempfindlichkeit der Leberzellen. Das zeigt eine Untersuchung von DZD-Forscherinnen und -Forschern aus Potsdam und Tübingen. Diese Ergebnisse wurden in der Zeitschrift Molecular Metabolism veröffentlich.
„Die Untersuchungen legen in Kombination mit unseren Beobachtungen aus Human- und Zellstudien nahe, dass eine erhöhte DPP4-Produktion in der Leber deren Verfettung sowie eine Insulinresistenz verursacht und nicht eine Folge der Leberverfettung ist“, betont Studienleiterin Annette Schürmann vom Deutschen Institut für Ernährungsforschung (DIfE), einem Partner des Deutschen Zentrums für Diabetesforschung (DZD).
Nach Ansicht der DZD-Wissenschaftlerinnen und Wissenschaftler lassen sich daher die bereits aus der Diabetestherapie bekannten DPP4-Inhibitoren künftig nicht nur nutzen, um den Zuckerstoffwechsel zu verbessern, sondern auch, um eine nicht-alkoholische Fettlebererkrankung zu behandeln.
Orignial-Publikation:
Christian Baumeier et al: Elevated hepatic DPP4 activity promotes insulin resistance and non-alcoholic fatty liver disease. Molecular Metabolism 2017; DOI: 10.1016/j.molmet.2017.07.016
Schlüssel-Molekül zur Verbesserung des Energiestoffwechsels
Pfluger PT, Kabra DG, Aichler M, Schriever SC, Pfuhlmann K, García VC, Lehti M, Weber J, Kutschke M, Rozman J, Elrod JW, Hevener AL, Feuchtinger A, Hrabě de Angelis M, Walch A, Rollmann SM, Aronow B, Müller TD, Perez-Tilve D, Jastroch M, De Luca M, Molkentin JD, Tschöp MH. Calcineurin Links Mitochondrial Elongation with Energy Metabolism.
doi: 10.1016/j.cmet.2015.08.022. Cell Metabolism. Sep 23, 2015
Wenn Ernährungsumstellung und Bewegungssteigerung nicht ausreichen, um Übergewicht abzubauen, könnten zukünftig medikamentöse Therapien helfen, die den Energiestoffwechsel optimieren. DZD-Wissenschaftler des Helmholtz Zentrum München haben gemeinsam mit einem internationalen Forscherteam die Rolle des Enzyms Calcineurin im Stoffwechsel entschlüsselt. Sie konnten sowohl im Fliegen- als auch im Mausmodell zeigen, dass nach genetischer und pharmakologischer Hemmung von Calcineurin die Gewichtszunahme durch kalorienreiche Nahrung reduziert wird.
Die Forscher vermuten, dass ein in der Evolution so hoch konservierter Mechanismus auch im Menschen ähnlich ist. Es würde also naheliegen, die Funktion von Calcineurin medikamentös zu unterbinden, um Fettsucht zu behandeln. Calcineurin-Hemmer werden hochdosiert bereits seit Jahren in der Klinik eingesetzt, um eine Abstoßungsreaktion nach Gewebstransplantationen zu verhindern. Sie haben in hoher Dosierung jedoch zahlreiche Nebenwirkungen. Mögliche Effekte von niedrigdosierten Calcineurin-Inhibitoren sollten nun bei adipösen Patienten untersucht werden. Eine dadurch erzielte Gewichtsreduktion könnte zur Prävention und Therapie des Typ-2-Diabetes beitragen.
Originalpublikation:
Pfluger PT, Kabra DG, Aichler M, Schriever SC, Pfuhlmann K, García VC, Lehti M, Weber J, Kutschke M, Rozman J, Elrod JW, Hevener AL, Feuchtinger A, Hrabě de Angelis M, Walch A, Rollmann SM, Aronow B, Müller TD, Perez-Tilve D, Jastroch M, De Luca M, Molkentin JD, Tschöp MH. Calcineurin Links Mitochondrial Elongation with Energy Metabolism. doi: 10.1016/j.cmet.2015.08.022. Cell Metabolism. Sep 23, 2015
Link zur Fachpublikation:
http://www.sciencedirect.com/science/article/pii/S1550413115004556
Diabetesprävention: Wer profitiert von Lebensstiländerung?
Stefan N, Staiger H, Wagner R, Machann J, Schick F, Häring HU, Fritsche A. A high-risk phenotype associates with reduced improvement in glycaemia during a lifestyle intervention in prediabetes.
doi: 10.1007/s00125-015-3760-z. Diabetologia. September 24, 2015
DZD-Wissenschaftler des Universitätsklinikums Tübingen konnten anhand von Daten aus dem „Tübinger Lebensstil Interventionsprogram (TULIP)“ zwei Phänotypen (Erscheinungsbilder) identifizieren, mit deren Bestimmung sich vorhersagen lässt, bei welchen Patienten durch eine Lebensstilintervention eine ausreichend hohe Reduktion von erhöhten Blutzuckerwerten zu erwarten ist. Teilnehmer der Studie waren Patienten, bei denen bereits eine Vorstufe des Diabetes (Prädiabetes) bestand. Erfolgsentscheidend ist demnach, ob Patienten eine Insulinsekretionsstörung und/oder eine Kombination aus nichtalkoholischer Fettleber mit Insulinresistenz aufweisen.
Menschen mit diesen Merkmalen hatten eine fast identische Gewichtsabnahme im Vergleich zu jenen Personen, bei denen die Konstellation nicht vorlag. Die Wahrscheinlichkeit, dass sie normale Blutzuckerwerte erreichten, war aber um das 4,5-fache geringer. Auf Basis der Studienergebnisse scheint zukünftig eine sinnvolle Phänotypisierung möglich zu werden. Das ist eine Voraussetzung dafür, dass Patienten mit Prädiabetes gezielt die für sie bestmöglichen Maßnahmen erhalten können. Um dies genauer zu untersuchen, wird nun bundesweit an 8 Universitäten und Forschungsinstituten die „Prädiabetes Lebensstil Interventionsstudie (PLIS)“ durchgeführt. Die Studie geht der Frage nach, ob bei Patienten, die auf herkömmliche Programme nicht ansprechen, durch eine intensivere Lebensstilintervention das Diabetesrisiko gesenkt werden kann.
Originalpublikation:
Stefan N, Staiger H, Wagner R, Machann J, Schick F, Häring HU, Fritsche A. A high-risk phenotype associates with reduced improvement in glycaemia during a lifestyle intervention in prediabetes. doi: 10.1007/s00125-015-3760-z. Diabetologia. September 24, 2015
Link zur Fachpublikation:
http://link.springer.com/article/10.1007%2Fs00125-015-3760-z
Forschung zu gesundem Altern: Ausschalten des Gens Indy/CeNac2 verlängert die Lebensspanne
Schwarz F, Karadeniz Z, Fischer-Rosinsky A, Willmes DM, Spranger J, Birkenfeld AL. Knockdown of Indy/CeNac2 extends Caenorhabditis elegans life span by inducing AMPK/aak-2.
Aging. August 20, 2015
Ein langes Leben bei guter Gesundheit – das wünschen sich viele. Der DZD-Forschungsgruppe um Prof. Andreas Birkenfeld am Universitätsklinikum Carl Gustav Carus der TU Dresden ist es gelungen, dem Geheimnis eines langen Lebens näher auf die Spur zu kommen. Eine wichtige Rolle spielt dabei das sogenannte Indy (“I am Not Dead Yet”) Gen. In der Fruchtfliege Drosophila melanogaster fördert es die Langlebigkeit.
Nun konnten die Forscher zeigen, dass das Ausschalten von Indy/CeNAC2 die Lebensspanne auch in dem Fadenwurm Caenorhabditis elegans verlängert. Dies geschieht zusammen mit einer Aktivierung des Energie-Sensors AMP-aktivierte Protein Kinase A (AMPK). Gleichzeitig kam es zu einer fast 50%-igen Reduktion des gesamten Körperfettanteils. Diese Entdeckung könnte auch für die zukünftige Diabetestherapie bei Menschen interessant sein, insbesondere, weil Mäuse, in denen Indy inaktiviert wird eine Verbesserung des Glukosestoffwechsels aufweisen.
Die neue Studie bekräftigt die Annahme, dass die Inaktivierung von Indy und die Aktivierung von AMPK neue attraktive Zielstrukturen zur Förderung von gesundem Altern und eventuell sogar einer Verlängerung der Lebensspanne darstellen könnten.
Originalpublikation:
Schwarz F, Karadeniz Z, Fischer-Rosinsky A, Willmes DM, Spranger J, Birkenfeld AL. Knockdown of Indy/CeNac2 extends Caenorhabditis elegans life span by inducing AMPK/aak-2. Aging. August 20, 2015
Link zur Fachpublikation
www.impactaging.com/papers/v7/n8/full/100791.html
Darmbakterien als möglicher Risikofaktor für Typ-2-Diabetes
Fugmann M, Breier M, Rottenkolber M, Banning F, Ferrari U, Sacco V, Grallert H, Parhofer KG, Seissler J, Clavel T, Lechner A. The stool microbiota of insulin resistant women with recent gestational diabetes, a high risk group for type 2 diabetes. doi: 10.1038/srep13212.
Nature Scientific Reports. August 17, 2015
Im menschlichen Darm leben mehrere Billionen Bakterien, die das „Darmmikrobiom“ bilden. Es ist bereits bekannt, dass sich das Darmmikrobiom von Menschen mit Typ-2-Diabetes von dem gesunder Personen unterscheidet. Aber wie sieht es bei jungen Erwachsenen aus, die zwar ein hohes Diabetesrisiko haben, aber noch nicht erkrankt sind? Dieser Frage gingen Münchner DZD-Forscher nach. Sie untersuchten insulinresistente Frauen, die einen Schwangerschaftsdiabetes hatten und eine Hochrisikogruppe für Typ-2-Diabetes darstellen, und verglichen diese mit Kontrollteilnehmerinnen.
Dabei zeigte sich, dass ein aus der Familie Prevotellaceae dominiertes Mikrobiom in der Risikogruppe signifikant häufiger vorkam. Dies ist der erste Hinweis auf ein verändertes Darmmikrobiom bereits bei jungen Risikopersonen. Prevotellaceae sind sogenannte Mucin-degradierende Bakterien, d. h. sie bauen die schützende Schleimschicht des Darms ab. Eine durch bakterielle Enzyme verminderte Barrierefunktion der Darmschleimhaut und eine nachfolgende entzündliche Reaktion mit verminderter  Insulinempfindlichkeit könnten als Erklärungsmodell für den Zusammenhang zwischen Prevotellaceae und Diabetes dienen. Die aktuelle Untersuchung ist allerdings zu klein, um definitive Aussagen zu machen. Darüber hinaus kann sie aufgrund ihres Studiendesigns keine kausalen Zusammenhänge belegen. In Nachfolgeuntersuchungen sollen deshalb die jetzt vorliegenden Ergebnisse überprüft und weiter vertieft werden. Da das Darmmikrobiom unter anderem durch die Ernährung beeinflusst werden kann, könnte es prinzipiell ein sehr guter Weg sein, um Typ-2-Diabetes bei Risikopersonen vorzubeugen.
Insulinempfindlichkeit könnten als Erklärungsmodell für den Zusammenhang zwischen Prevotellaceae und Diabetes dienen. Die aktuelle Untersuchung ist allerdings zu klein, um definitive Aussagen zu machen. Darüber hinaus kann sie aufgrund ihres Studiendesigns keine kausalen Zusammenhänge belegen. In Nachfolgeuntersuchungen sollen deshalb die jetzt vorliegenden Ergebnisse überprüft und weiter vertieft werden. Da das Darmmikrobiom unter anderem durch die Ernährung beeinflusst werden kann, könnte es prinzipiell ein sehr guter Weg sein, um Typ-2-Diabetes bei Risikopersonen vorzubeugen.
Originalpublikation:
Fugmann M, Breier M, Rottenkolber M, Banning F, Ferrari U, Sacco V, Grallert H, Parhofer KG, Seissler J, Clavel T, Lechner A. The stool microbiota of insulin resistant women with recent gestational diabetes, a high risk group for type 2 diabetes. doi: 10.1038/srep13212. Nature Scientific Reports. August 17, 2015
Link zur Fachpublikation:
http://www.nature.com/articles/srep13212
Neue diabetesrelevante Gene entschlüsselt
Hrabě de Angelis, M. et al. Analysis of mammalian gene function through broad-based phenotypic screens across a consortium of mouse clinics.
Nature Genetics. doi: 10.1038/ng.3360. September 1, 2015
Die Funktion der Mehrzahl der Säugetier-Gene und deren Rolle für Gesundheit und Krankheit sind trotz intensiver Forschung immer noch unklar. In einer bislang einzigartigen Studie haben DZD-Forscher des Helmholtz Zentrum München zusammen mit Kollegen aus dem europäischen Konsortium EUMODIC nun die Daten von genetisch unterschiedlichen Mauslinien ausgewertet, um neue krankheitsrelevante Bezüge zu entdecken.
Prof. Martin Hrabě de Angelis und seine Kollegen etablierten dafür standardisierte Untersuchungen an krankheitsrelevanten Organsystemen. Die Forscher entwickelten spezielle statistische Verfahren, die erlauben, signifikante Aussagen über die entsprechende Funktion der Gene zu treffen. Bei der Untersuchung von 320 verschiedenen Genen konnten 160 Genen gesundheitsrelevante Funktionen zugeordnet werden. Sie spielen unter anderem eine Rolle bei Stoffwechselprozessen und könnten daher hoffnungsvolle Kandidaten für neue Forschungsansätze gegen Diabetes sein. Der Datensatz steht nun auch anderen Forschungsgruppen kostenfrei über die Webseite des IMPC (International Mouse Phenotyping Consortium) für weitere Untersuchungen zur Verfügung.
Originalpublikation:
Hrabě de Angelis, M. et al. Analysis of mammalian gene function through broad-based phenotypic screens across a consortium of mouse clinics. Nature Genetics. doi: 10.1038/ng.3360. September 1, 2015
Link zur Fachpublikation:
http://www.nature.com/ng/journal/v47/n9/full/ng.3360.html
Neuer Diabetestyp chirurgisch reversibel
Ehehalt F, Sturm D, Rösler M, Distler M, Weitz J, Kersting S, Ludwig B, Schwanebeck U, Saeger HD, Solimena M, Grützmann R. Blood Glucose Homeostasis in the Course of Partial Pancreatectomy – Evidence for Surgically Reversible Diabetes Induced by Cholestasis.
doi: 10.1371/journal.pone.0134140.
PLoS One. August 6, 2015
DZD-Wissenschaftler des Paul Langerhans Instituts Dresden beschreiben erstmals eine bestimmte Form des Diabetes, der in Zusammenhang mit einem Tumor der Bauchspeicheldrüse entsteht und sich nach chirurgischer Entfernung des Tumors wieder zurückbilden kann.
Als Ursache für die Entstehung dieses spezifischen, chirurgisch-reversiblen Diabetes-Subtyps vermuten die Wissenschaftler auf Basis ihrer Studiendaten, dass der Tumor der Bauchspeicheldrüse auf den benachbarten Gallengang drückt. Dadurch kann es zu einem ganzen oder teilweisen Verschluss kommen, wodurch sich die Galle in der Leber staut (Cholestase). Als Folge kann dies die Leberfunktion beeinträchtigen und zu einer gesteigerten Insulinresistenz und damit zu einem Diabetes führen. Die Forscher bezeichnen diesen Diabetes-Subtyp entsprechend als “Cholestase-induzierten Diabetes”.
Patienten dieser Studie, bei denen sich die Operation positiv auf den Diabetes auswirkte, hatten einen gutartigen oder bösartigen Tumor, waren meist älter als 50 Jahre, ihr Diabetes war erst kürzlich diagnostiziert worden, und sie wiesen bei Blutuntersuchungen auffällige Werte auf, die beispielsweise auf einen Gallengangverschluss, eine akute Entzündung der Bauchspeicheldrüse oder einen Leberzell-Schaden hinwiesen. Langfristig können diese Ergebnisse dabei helfen, dass Ärzte und Patienten die Auswirkungen einer teilweisen Entfernung der Bauchspeicheldrüse auf den Blutzuckerstoffwechsel bereits vor der Operation besser einschätzen können.
Originalpublikation:
Ehehalt F, Sturm D, Rösler M, Distler M, Weitz J, Kersting S, Ludwig B, Schwanebeck U, Saeger HD, Solimena M, Grützmann R. Blood Glucose Homeostasis in the Course of Partial Pancreatectomy – Evidence for Surgically Reversible Diabetes Induced by Cholestasis.
doi: 10.1371/journal.pone.0134140. PLoS One. August 6, 2015
Positiver Nebeneffekt: Diabetes-Medikament senkt Cholesterinspiegel
Xu T, Brandmaier S, Messias AC, Herder C, Draisma HH, Demirkan A, Yu Z, Ried JS, Haller T, Heier M, Campillos M, Fobo G, Stark R, Holzapfel C, Adam J, Chi S, Rotter M, Panni T, Quante AS, He Y, Prehn C, Roemisch-Margl W, Kastenmüller G, Willemsen G, Pool R, Kasa K, van Dijk KW, Hankemeier T, Meisinger C, Thorand B, Ruepp A, Hrabé de Angelis M, Li Y, Wichmann HE, Stratmann B, Strauch K, Metspalu A, Gieger C, Suhre K, Adamski J, Illig T, Rathmann W, Roden M, Peters A, van Duijn CM, Boomsma DI, Meitinger T, Wang-Sattler R. Effects of Metformin on Metabolite Profiles and LDL Cholesterol in Patients With Type 2 Diabetes. doi: 10.2337/dc15-0658.
Der Wirkstoff Metformin senkt nicht nur den Blutzucker, sondern auch die Blutfette. Das fand ein interdisziplinäres Wissenschaftlerteam des DZD um Dr. Rui-Wang Sattler vom Helmholtz Zentrum München heraus. Speziell das LDL-Cholesterin kann gesenkt werden.
Die DZD-Wissenschaftler vom Helmholtz Zentrum München und dem Deutschen Diabetes Zentrum Düsseldorf hatten für ihre Analyse die Blutproben von über 1.800 Patienten der KORA-Studie* sowohl genetisch als auch hinsichtlich ihrer Stoffwechselprodukte (Metabolite) untersucht. So führte die Gabe von Metformin bei Patienten mit Typ-2-Diabetes zu einem niedrigeren LDL-Cholesterinspiegel. Hohe LDL-Cholesterinkonzentrationen stehen im Verdacht, durch Gefäßverkalkungen Herz-Kreislauf-Erkrankungen zu begünstigen. 
Die Studienergebnisse legen nahe, dass Metformin einen positiven Effekt gegen kardiovaskuläre Erkrankungen hat und somit einen zusätzlichen Nutzen für die Patienten erbringen könnte. Der exakte Wirkmechanismus von Metformin soll auf molekularer Ebene weiter entschlüsselt werden.
*Die Kooperative Gesundheitsforschung in der Region Augsburg (KORA) Plattform untersucht seit über 20 Jahren die Gesundheit tausender Bürger aus dem Raum Augsburg.
Originalpublikation:
Xu T, Brandmaier S, Messias AC, Herder C, Draisma HH, Demirkan A, Yu Z, Ried JS, Haller T, Heier M, Campillos M, Fobo G, Stark R, Holzapfel C, Adam J, Chi S, Rotter M, Panni T, Quante AS, He Y, Prehn C, Roemisch-Margl W, Kastenmüller G, Willemsen G, Pool R, Kasa K, van Dijk KW, Hankemeier T, Meisinger C, Thorand B, Ruepp A, Hrabé de Angelis M, Li Y, Wichmann HE, Stratmann B, Strauch K, Metspalu A, Gieger C, Suhre K, Adamski J, Illig T, Rathmann W, Roden M, Peters A, van Duijn CM, Boomsma DI, Meitinger T, Wang-Sattler R. Effects of Metformin on Metabolite Profiles and LDL Cholesterol in Patients With Type 2 Diabetes. doi: 10.2337/dc15-0658. Diabetes Care. August 5, 2015
Link zur Fachpublikation:
http://care.diabetesjournals.org/content/early/2015/07/27/dc15-0658.abstract
Lactobacillus reuteri verbessert Darmhormon- und Insulinausschüttung
Simon MC, Strassburger K, Nowotny B, Kolb H, Nowotny P, Burkart V, Zivehe F, Hwang JH, Stehle P, Pacini G, Hartmann B, Holst JJ, MacKenzie C, Bindels LB, Martinez I, Walter J, Henrich B, Schloot NC, Roden M. Intake of Lactobacillus reuteri Improves Incretin and Insulin Secretion in Glucose Tolerant Humans: A Proof of Concept. doi: 10.2337/dc14-2690.
Diabetes Care. June 17, 2015
Übergewichtige und Menschen mit Typ-2-Diabetes können im Vergleich zu Gesunden eine veränderte Darmflora aufweisen. Könnte die Einnahme von Probiotika ein neuer Weg in der Therapie dieser Erkrankungen sein? DZD-Wissenschaftler des Deutschen Diabetes-Zentrum DDZ in Düsseldorf untersuchten gemeinsam mit einem internationalen Forscherteam die tägliche Einnahme des Probiotikums Lactobacillus reuteri. Bei den Anwendern kam es zu einer vermehrten Freisetzung der Darmhormone GLP-1 und GLP-2 nach Nahrungsaufnahme. Das Darmhormon GLP-1 fördert in Abhängigkeit vom Zuckergehalt der Nahrung die Insulinausschüttung. In der Studie zeigte sich eine 49 % höhere Insulinausschüttung bei den Teilnehmern, die Lactobacillus reuteri einnahmen, im Vergleich zu Placebo. Das Ansprechen der Körperzellen auf Insulin und die Körperfettverteilung wurden jedoch nicht beeinflusst.
Die Anwendung von Lactobacillus reuteri scheint also über die vermehrte Freisetzung von Darmhormonen die Insulinausschüttung zu steigern. Folglich könnte die Einnahme spezifischer Bakterien als neuer therapeutischer Ansatz dienen, um die glukoseabhängige Insulinfreisetzung zu verbessern.
Originalpublikation:
Simon MC, Strassburger K, Nowotny B, Kolb H, Nowotny P, Burkart V, Zivehe F, Hwang JH, Stehle P, Pacini G, Hartmann B, Holst JJ, MacKenzie C, Bindels LB, Martinez I, Walter J, Henrich B, Schloot NC, Roden M. Intake of Lactobacillus reuteri Improves Incretin and Insulin Secretion in Glucose Tolerant Humans: A Proof of Concept. doi: 10.2337/dc14-2690. Diabetes Care. June 17, 2015
Link zur Fachpublikation:
http://care.diabetesjournals.org/content/early/2015/05/15/dc14-2690.long
Auswirkungen des Alters auf die Insulinwirkung im Gehirn
Sartorius T, Peter A, Heni M, Maetzler W, Fritsche A, Häring HU, Hennige AM. The brain response to peripheral insulin declines with age: a contribution of the blood-brain barrier? doi: 10.1371/journal.pone.0126804.
PLoS One. May 12, 2015
Welchen Einfluss hat das Alter auf die Insulinwirkung im Gehirn? DZD-Wissenschaftler des Instituts für Diabetesforschung und Metabolische Erkrankungen (IDM) und Wissenschaftler des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) gingen dieser Frage nach. Sie verglichen die Insulinkonzentration im zentralen Nervensystem und im restlichen Körper. Bei jungen Menschen bestand ein enger Zusammenhang zwischen der Insulinkonzentration in der Hirnflüssigkeit und im Blut. Mit zunehmendem Alter wurde der Anteil von Insulin in der Hirnflüssigkeit im Verhältnis zum Anteil im Blut jedoch geringer.
Insulin wird von den Betazellen der Bauchspeicheldrüse produziert. Um ins Gehirn zu gelangen, muss Insulin die Bluthirnschranke überwinden. Die Untersuchungen deuten darauf hin, dass dies in höherem Lebensalter schlechter gelingt. Im Tiermodell konnten die Forscher zeigen, dass auch die Gehirnaktivität, die durch unter die Haut gespritztes Insulin hervorgerufen wird, vom Alter abhängt.
Ein unzureichender Insulintransport über die Bluthirnschranke ins zentrale Nervensystem könnte zur beeinträchtigten Insulinwirkung bei Älteren beitragen, wodurch der Zuckerstoffwechsel gestört wird. Diese Ergebnisse sind wichtig für die Entwicklung neuer Präventions- und Therapieansätze gegen Diabetes – vor allem im Hinblick auf unsere alternde Gesellschaft.
Originalpublikation:
Sartorius T, Peter A, Heni M, Maetzler W, Fritsche A, Häring HU, Hennige AM. The brain response to peripheral insulin declines with age: a contribution of the blood-brain barrier? doi: 10.1371/journal.pone.0126804. PLoS One. May 12, 2015
Link zur Fachpublikation:
http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0126804
Besseres Verständnis von Stoffwechselerkrankungen durch Visualisierung der Verdauung
Heinzmann SS, Schmitt-Kopplin P. Deep metabotyping of the murine gastrointestinal tract for the visualization of digestion and microbial metabolism. doi: 10.1021/acs.jproteome.5b00034.
J Proteome Res. May 1, 2015
Übergewicht und Diabetes werden durch Stoffwechselvorgänge im Magen-Darm-Trakt beeinflusst. DZD-Wissenschaftler des Helmholtz Zentrum München nahmen daher die einzelnen Verdauungsabschnitte genauer unter die Lupe. Mittels hochauflösender NMR-Spektroskopie untersuchten sie die Verdauungssäfte und Stoffwechselprodukte. Durch die Anwendung dieser Technologie konnten die Stoffwechselwege und enzymatischen Reaktionen genau den entsprechenden Darmabschnitten zugeordnet werden. Daraus wurde eine umfangreiche Liste der jeweils vorkommenden Stoffwechselprodukte erstellt.
Auf dieser Grundlage können zukünftig  Stoffwechselerkrankungen besser untersucht werden. Umfassendere Kenntnisse des Stoffwechsels in den einzelnen Abschnitten des Verdauungstrakts führen zu einem besseren Verständnis von Erkrankungen wie Diabetes und Adipositas. Daraus lassen sich in Zukunft auch neue Therapien ableiten.
Stoffwechselerkrankungen besser untersucht werden. Umfassendere Kenntnisse des Stoffwechsels in den einzelnen Abschnitten des Verdauungstrakts führen zu einem besseren Verständnis von Erkrankungen wie Diabetes und Adipositas. Daraus lassen sich in Zukunft auch neue Therapien ableiten.
Originalpublikation:
Heinzmann SS, Schmitt-Kopplin P. Deep metabotyping of the murine gastrointestinal tract for the visualization of digestion and microbial metabolism. doi: 10.1021/acs.jproteome.5b00034. J Proteome Res. May 1, 2015
Link zur Fachpublikation:
http://pubs.acs.org/doi/abs/10.1021/acs.jproteome.5b00034
Zusammenhang zwischen rotem Fleisch und Typ-2-Diabetesrisiko
Wittenbecher C, Mühlenbruch K, Kröger J, Jacobs S, Kuxhaus O, Floegel A, Fritsche A, Pischon T, Prehn C, Adamski J, Joost HG, Boeing H, Schulze MB. Amino acids, lipid metabolites, and ferritin as potential mediators linking red meat consumption to type 2 diabetes. doi: 10.3945/ajcn.114.099150.
Am J Clin Nutr. June 1, 2015
Wie zahlreiche Beobachtungsstudien zeigen, haben Menschen, die viel rotes Fleisch (Rind-, Schweine- oder Lammfleisch) essen, ein erhöhtes Risiko für Typ-2-Diabetes. Ein interdisziplinäres DZD-Forscherteam um Matthias Schulze hat Biomarker identifiziert, die erste Hinweise auf die Stoffwechselmechanismen geben, die der Risikobeziehung zugrunde liegen könnten.
Dazu analysierte das Team mit Epidemiologen vom Deutschen Institut für Ernährungsforschung Potsdam-Rehbrücke (DIfE), Metabolomics-Experten vom Helmholtz Zentrum München und Klinikern der Universität Tübingen die Blutproben von 2.681 Potsdamer EPIC*-Studienteilnehmern unter Berücksichtigung des Fleischkonsums und der Erkrankung an Typ-2-Diabetes. Hohe Ferritinspiegel und niedrige Konzentrationen des Eiweißbausteins Glyzin standen sowohl mit einem hohen Fleischverzehr als auch mit einem erhöhten Diabetesrisiko in Verbindung. Ebenso waren bei Teilnehmern mit hohem Fleischverzehr die Werte von vier Lipiden verändert, die von der Leber ans Blut abgegeben werden.
Hohe Ferritinspiegel bedeuten, dass die Eisenspeicher voll sind. Zuviel Eisen kann zu oxidativem Stress führen, der die Zellen schädigt. Glyzin ist am körpereigenen Schutz vor oxidativem Stress beteiligt und kann Entzündungsreaktionen entgegen wirken. Dies könnte den Zusammenhang zwischen dem Verzehr von rotem Fleisch und Diabetes erklären, da oxidativer Stress sowie Entzündungsreaktionen zur Typ-2-Diabetes-Entstehung beitragen. Die veränderten Lipidwerte weisen auf einen gestörten Fettstoffwechsel der Leber hin, der ebenfalls an der Krankheitsentstehung beteiligt ist.
* European Prospective Investigation into Cancer and Nutrition
Originalpublikation:
Wittenbecher C, Mühlenbruch K, Kröger J, Jacobs S, Kuxhaus O, Floegel A, Fritsche A, Pischon T, Prehn C, Adamski J, Joost HG, Boeing H, Schulze MB. Amino acids, lipid metabolites, and ferritin as potential mediators linking red meat consumption to type 2 diabetes. doi: 10.3945/ajcn.114.099150. Am J Clin Nutr. June 1, 2015
Link zur Fachpublikation:
http://ajcn.nutrition.org/content/101/6/1241.long
Fettleberentzündung durch Stress aufgrund übermäßiger Fettverbrennung
Koliaki C, Szendroedi J, Kaul K, Jelenik T, Nowotny P, Jankowiak F, Herder C, Carstensen M, Krausch M, Knoefel WT, Schlensak M, Roden M. Adaptation of Hepatic Mitochondrial Function in Humans with Non-Alcoholic Fatty Liver Is Lost in Steatohepatitis. doi: 10.1016/j.cmet.2015.04.004,
Cell Metabolism May 5, 2015
Übergewicht und Typ-2-Diabetes können zu Fettlebererkrankungen führen, die nicht durch übermäßigen Alkoholkonsum verursacht sind (NAFLD = nicht-alkoholische Fettlebererkrankungen). Im weiteren Verlauf kann daraus eine Fettleberentzündung (NASH) entstehen. Erstmals untersuchten DZD-Wissenschaftler direkt die Funktion der Mitochondrien, der Kraftwerke der Zellen, in der Leber von Gesunden und Patienten, um diesen Zusammenhang zu entschlüsseln.
Dabei entdeckten die Wissenschaftler des Deutschen Diabetes-Zentrums (DDZ), das Partner im DZD ist, in Kooperation mit Wissenschaftlern des Universitätsklinikums Düsseldorf und des St. Martinus Krankenhauses, dass stark übergewichtige Patienten mit NAFLD eine deutlich erhöhte Aktivität der Mitochondrien in der Leber aufweisen. Mit dem weiteren Fortschreiten zur Fettleberentzündung nehmen die Leistungen der Mitochondrien jedoch ab und der oxidative Stress zu. Dies ist darauf zurückzuführen, dass die Leber in frühen Stadien des Übergewichtes zuerst vermehrt überschüssiges Fett verbrennt. Dadurch wird sie aber überlastet und die Erkrankung kann fortschreiten.
Diese Erkenntnisse liefern neuartige Ansätze zur Vorbeugung und Behandlung von Fettlebererkrankungen, die in Zusammenhang mit Übergewicht und Typ-2-Diabetes auftreten.
Originalpublikation:
Koliaki C, Szendroedi J, Kaul K, Jelenik T, Nowotny P, Jankowiak F, Herder C, Carstensen M, Krausch M, Knoefel WT, Schlensak M, Roden M. Adaptation of Hepatic Mitochondrial Function in Humans with Non-Alcoholic Fatty Liver Is Lost in Steatohepatitis. doi: 10.1016/j.cmet.2015.04.004, Cell Metabolism May 5, 2015
Link zur Fachpublikation:
http://www.sciencedirect.com/science/article/pii/S155041311500159X
Insulinwirkung auf Gehirnregionen bei Übergewichtigen
Kullmann S, Heni M, Veit R, Scheffler K, Machann J, Häring HU, Fritsche A, Preissl H. Selective Insulin Resistance in Homeostatic and Cognitive Control Brain Areas in Overweight and Obese Adults. doi: 10.2337/dc14-2319,
Diabetes Care March 20, 2015
Unser Gehirn ist an der Steuerung des Essverhaltens beteiligt. Bei Übergewichtigen geraten Regulationsmechanismen aus dem Gleichgewicht. Die Ursachen und Zusammenhänge werden derzeit erforscht. Erstmals untersuchten DZD-Wissenschaftler nun die Wirkung von Insulin auf einzelne Gehirnregionen.
Dazu verglichen sie Übergewichtige und Schlanke, denen Insulin als Nasenspray verabreicht wurde – so gelangt das Insulin direkt ins Gehirn. Dr. Stephanie Kullmann und Dr. Hubert Preißl fanden mit ihren Kollegen vom Institut für Diabetesforschung und Metabolische Erkrankungen des Helmholtz Zentrum München an der Eberhard-Karls-Universität Tübingen heraus, dass zwei wichtige Gehirnregionen durch Insulin beeinflusst werden: Der sogenannte präfrontale Kortex (eine Region der Hirnrinde, die bei der Fällung von Entscheidungen eine Rolle spielt) und der Hypothalamus (der zu einem System im Gehirn gehört, das die Energiebilanz des Körpers steuert).
Nach Insulingabe verringerte sich der Blutfluss im Hypothalamus sowohl bei Schlanken als auch bei Übergewichtigen. Das Ausmaß der Änderung war jedoch bei Menschen mit höherem Fettgewebsanteil um die inneren Organe stärker. Im präfrontalen Kortex kam es nur bei Schlanken zu einer Verringerung des Blutflusses. Diese Teilnehmer verspürten eine Stunde nach der Insulingabe ein geringes Verlangen nach süßen Lebensmitteln. 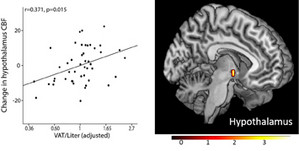
Die Entdeckung von Mechanismen, die das Gehirn bei der Regulierung der Nahrungsaufnahme beeinflussen, könnte für die Entwicklung von Therapien gegen Übergewicht hilfreich sein. Da Übergewicht ein Risikofaktor für Diabetes ist, würde dies auch zur Vorbeugung von Diabetes beitragen.
Originalpublikation:
Kullmann S, Heni M, Veit R, Scheffler K, Machann J, Häring HU, Fritsche A, Preissl H. Selective Insulin Resistance in Homeostatic and Cognitive Control Brain Areas in Overweight and Obese Adults. doi: 10.2337/dc14-2319, Diabetes Care March 20, 2015
Link zur Fachpublikation:
http://care.diabetesjournals.org/content/early/2015/03/19/dc14-2319.long
Erfolgreicher erster Schritt zur Vorbeugung des Typ-1-Diabetes
Bonifacio E, Ziegler AG, Klingensmith G, Schober E, Bingley PJ, Rottenkolber M, Theil A, Eugster A, Puff R, Peplow C, Buettner F, Lange K, Hasford J, Achenbach P. Pre-POINT Study Group. Effects of High-Dose Oral Insulin on Immune Responses in Children at High Risk for Type 1 Diabetes: The Pre-POINT Randomized Clinical Trial. doi: 10.1001/jama.2015.2928,
JAMA April 21, 2015
Ein wichtiger Durchbruch in der Prävention des Typ-1-Diabetes ist DZD-Wissenschaftlern des Paul Langerhans Institut Dresden und des Helmholtz Zentrum München gemeinsam mit Forschern aus Wien, Bristol und Denver (USA) gelungen: Sie konnten im Rahmen der internationalen Pre-POINT-Studie durch orale Verabreichung von Insulin eine positive Immunreaktion bei Kindern mit erhöhtem Diabetesrisiko erzielen. Das Besondere ist, dass das Insulin prophylaktisch als Impfstoff zu einem Zeitpunkt verabreicht wurde, an dem die Kinder noch keine Autoimmunreaktion – also noch keine Autoantikörper – entwickelt hatten. Dabei traten keine unerwünschten Nebenwirkungen wie Unterzuckerung auf.
Ziel dieser Insulin-Impfung ist, eine Immuntoleranz gegen körpereigene Proteine zu entwickeln. Dadurch soll eine Autoimmunreaktion, die zum Typ-1-Diabetes führen kann, verhindert werden. Es wird angestrebt, in nachfolgenden Studien eine größere Anzahl von Teilnehmern mit hohem Erkrankungsrisiko für Typ-1-Diabetes zu behandeln. Sollte der Impfstoff die Autoimmunerkrankung dauerhaft verhindern, wäre eine flächendeckende Vorsorgeimpfung möglich.
Originalpublikation:
Bonifacio E, Ziegler AG, Klingensmith G, Schober E, Bingley PJ, Rottenkolber M, Theil A, Eugster A, Puff R, Peplow C, Buettner F, Lange K, Hasford J, Achenbach P. Pre-POINT Study Group. Effects of High-Dose Oral Insulin on Immune Responses in Children at High Risk for Type 1 Diabetes: The Pre-POINT Randomized Clinical Trial. doi: 10.1001/jama.2015.2928, JAMA April 21, 2015
Link zur Fachpublikation:
http://jama.jamanetwork.com/article.aspx?articleid=2275446
Innovativer Ansatz zur Untersuchung des Stoffwechsels
Wahl S, Vogt S, Stückler F, Krumsiek J, Bartel J, Kacprowski T, Schramm K, Carstensen M, Rathmann W, Roden M, Jourdan C, Kangas AJ, Soininen P, Ala-Korpela M, Nöthlings U, Boeing H, Theis FJ, Meisinger C, Waldenberger M, Suhre K, Homuth G, Gieger C, Kastenmüller G, Illig T, Linseisen J, Peters A, Prokisch H, Herder C, Thorand B, Grallert H. Multi-omic signature of body weight change: results from a population-based cohort study. doi:10.1186/s12916-015-0282-y
BMC Medicine March 9, 2015
Welchen Einfluss haben Gewichtsveränderungen auf den Stoffwechsel in der Allgemeinbevölkerung? Um diese Frage auf molekularer Ebene beantworten zu können, haben DZD-Wissenschaftler des Helmholtz Zentrum München, des Deutschen Diabetes-Zentrum in Düsseldorf (DDZ) und des DIfE – Deutschen Institut für Ernährungsforschung Potsdam-Rehbrücke Daten der KORA-Studie* ausgewertet. Der Einsatz von Techniken wie „Metabolomics“ und „Transcriptomics“ ermöglicht die gleichzeitige Bestimmung einer Vielzahl von Stoffwechselprodukten und Genaktivitäten. Dadurch können molekulare Zusammenhänge noch besser untersucht werden. Mit diesem neuen Ansatz verbessert sich das  Verständnis des Stoffwechsels. Die gewonnenen Daten bieten beispielsweise eine wertvolle Basis für die Beantwortung der Frage, welchen Einfluss eine Gewichtszunahme auf die Insulinwirkung im Körper hat.
Verständnis des Stoffwechsels. Die gewonnenen Daten bieten beispielsweise eine wertvolle Basis für die Beantwortung der Frage, welchen Einfluss eine Gewichtszunahme auf die Insulinwirkung im Körper hat.
*Die Kooperative Gesundheitsforschung in der Region Augsburg (KORA) Plattform untersucht seit über 20 Jahren die Gesundheit tausender Bürger aus dem Raum Augsburg.
Originalpublikation:
Wahl S, Vogt S, Stückler F, Krumsiek J, Bartel J, Kacprowski T, Schramm K, Carstensen M, Rathmann W, Roden M, Jourdan C, Kangas AJ, Soininen P, Ala-Korpela M, Nöthlings U, Boeing H, Theis FJ, Meisinger C, Waldenberger M, Suhre K, Homuth G, Gieger C, Kastenmüller G, Illig T, Linseisen J, Peters A, Prokisch H, Herder C, Thorand B, Grallert H. Multi-omic signature of body weight change: results from a population-based cohort study. doi:10.1186/s12916-015-0282-y,
BMC Medicine March 9, 2015
Link zur Fachpublikation:
http://www.biomedcentral.com/1741-7015/13/48/abstract
Hustenstiller verbessert Blutglukosekonzentration
Marquard J., Otter S., Welters A., Stirban A., Fischer A., Eglinger J., Herebian D., Kletke O., Klemen M.S., Stožer A., Wnendt S., Piemonti L., Köhler M., Ferrer J., Thorens B., Schliess F., Rupnik M.S., Heise T., Berggren PO., Klöcker N., Meissner T., Mayatepek E., Eberhard D., Kragl M., Lammert E. Characterization of pancreatic NMDA receptors as possible drug targets for diabetes treatment. doi: 10.1038/nm.3822
Nature Medicine March 16, 2015
Der Wirkstoff Dextromethorphan wird bisher als Hustenstiller angewandt. DZD-Wissenschaftler Eckhard Lammert und seine Kollegen haben nun herausgefunden, dass diese Substanz auch die Insulinausschüttung steigert und die Blutglukosekonzentration senkt.
Wie aus der Veröffentlichung in der Fachzeitschrift Nature Medicine hervorgeht, bindet Dextromethorphan an sogenannte N-Methyl-D-Aspartat (NMDA) Rezeptoren der Betazelle – dem Produktionsort des Insulins im menschlichen Körper. Dadurch verstärkt sich die Insulinausschüttung, wenn mehr Glukose im Blut vorhanden ist. So wird der Blutzucker besser reguliert. Auch schützt dieser Wirkstoff unter experimentellen Bedingungen Betazellen vor einem Zelltod, was für Patienten mit einem frisch diagnostizierten Typ-1-Diabetes von Interesse sein könnte. 
Folglich ist der Wirkstoff nicht nur gegen Reizhusten, sondern auch als neue Behandlungsmöglichkeit für Diabetes interessant. Dies wurde bereits an 20 Patienten mit Typ-2-Diabetes erfolgreich getestet. Langzeitstudien sollen nun den möglichen Nutzen von Dextromethorphan für Menschen mit Diabetes besser untersuchen.
Originalpublikation:
Marquard J., Otter S., Welters A., Stirban A., Fischer A., Eglinger J., Herebian D., Kletke O., Klemen M.S., Stožer A., Wnendt S., Piemonti L., Köhler M., Ferrer J., Thorens B., Schliess F., Rupnik M.S., Heise T., Berggren PO., Klöcker N., Meissner T., Mayatepek E., Eberhard D., Kragl M., Lammert E. Characterization of pancreatic NMDA receptors as possible drug targets for diabetes treatment. doi: 10.1038/nm.3822
Nature Medicine March 16, 2015
Link zur Fachpublikation:
http://www.nature.com/nm/journal/vaop/ncurrent/full/nm.3822.html
Insulinausschüttung: Alter der Granula entscheidend
Hoboth, P., Müller, A., Ivanova A., Mziaut H., Dehghany J., Sönmez A., Lachnit M., Meyer-Hermann M., Kalaidzidis Y., Solimena M. Aged insulin granules display reduced microtubule-dependent mobility and are disposed within actin-positive multigranular bodies. doi: 10.1073/pnas.1409542112 PNAS February 2, 2015
Welche Faktoren haben Einfluss auf die Insulinfreisetzung? Insulin wird in den Betazellen der Bauchspeicheldrüse in Insulin-Granula gespeichert. Wenn mehr Insulin im Blut benötigt wird, wandern die Granula zur Zellmembran und setzen Insulin frei (= Exozytose).
Unabhängige Hinweise deuten darauf hin, dass neu produzierte sekretorische Insulin-Granula bevorzugt sekretiert werden und mobiler sind als ihre älteren Gegenstücke. Die Mechanismen, die für diese unterschiedliche Mobilität und Neigung zur Exozytose von sekretorischen Granula verschiedenen Alters verantwortlich sind, waren bisher nicht bekannt. Nun fanden Dr. Peter Hoboth und Prof. Michele Solimena mit ihrem Team heraus, dass gealterte sekretorische Granula eine verminderte Kompetenz für Glukose-stimulierten Transport aufweisen. Die Daten zeigen eine deutliche Verbindung zwischen dem  Alter der sekretorischen Granula und deren Mobilität und sind deswegen ein entscheidender Beitrag, um die Insulinsekretion bei Gesunden und bei Diabetes besser zu verstehen. Sie könnten auch helfen, neue Medikamente zur Verbesserung der Insulinausschüttung zu entwickeln.
Alter der sekretorischen Granula und deren Mobilität und sind deswegen ein entscheidender Beitrag, um die Insulinsekretion bei Gesunden und bei Diabetes besser zu verstehen. Sie könnten auch helfen, neue Medikamente zur Verbesserung der Insulinausschüttung zu entwickeln.
Originalpublikation:
Hoboth, P., Müller, A., Ivanova A., Mziaut H., Dehghany J., Sönmez A., Lachnit M., Meyer-Hermann M., Kalaidzidis Y., Solimena M. Aged insulin granules display reduced microtubule-dependent mobility and are disposed within actin-positive multigranular bodies. doi: 10.1073/pnas.1409542112
PNAS February 2, 2015
Link zur Fachpublikation:
http://www.pnas.org/content/112/7/E667.long
Publikationslisten
2022,
Die Wissenschaftlerinnen und Wissenschaftler des DZD verwenden folgende Affiliation in wissenschaftlichen Publikationen:
Deutsches Zentrum für Diabetesforschung (DZD), Ort* bzw.
German Center for Diabetes Research (DZD), Site*
* wenn vom Journal verlangt